Суточная доза пенициллина при менингококковом менингите
Содержание статьи
Менингококковый менингит
Менингококковый менингит — это форма менингококковой инфекции, которая характеризуется гнойным воспалением мягкой и арахноидальной оболочек головного мозга. Заболевание сопровождается типичной триадой клинических признаков (головной болью, лихорадкой и рвотой), менингеальными знаками, общемозговыми и общетоксическими симптомами. Менингит может сочетаться с менингококцемией, осложняться инфекционно-токсическим шоком, недостаточностью надпочечников, энцефалитом. Решающее значение в диагностике играют методы лабораторной идентификации возбудителя. Основу лечения составляет антибактериальная и патогенетическая терапия.
Общие сведения
Менингококковую природу имеют 80% первичных бактериальных менингитов. В виде спорадических случаев или небольших вспышек патология регистрируется повсеместно. Наибольшая распространенность отмечается в странах Африки и Азии — только в «менингитном поясе» (от Сенегала до Эфиопии) ежегодно выявляют около 30 000 заболевших. В западных странах жители страдают с частотой 0,9-1,5 случаев на 100 тыс. населения, общемировая статистика свидетельствует о 0,5 млн. пораженных. Пик заболеваемости обычно приходится на зимне-весенний период. Менингит может развиваться в любом возрасте, но большинство случаев диагностируются у детей и подростков (80%), молодых людей — без существенных гендерных отличий.
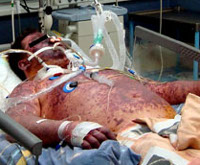
Менингококковый менингит
Причины
Этиологическим фактором менингококкового менингита является менингококк — Neisseria meningitidis. Это парно расположенная шаровидная грамотрицательная бактерия (диплококк), окруженная капсулой с ресничками. Возбудитель обладает низкой устойчивостью к факторам внешней среды, быстро погибает под действием ультрафиолетовых лучей, высоких и низких температур. Менингококки относятся к аэробам, чувствительны к показателям pH, дезинфицирующим агентам.
Микроб имеет сложную антигенную структуру. Различают 13 серогрупп N. meningitidis, отличающихся составом специфического капсульного полисахарида. Наиболее распространены штаммы групп A, B, C, в последнее время регистрируют рост частоты выявления бактерий с антигенами Y и W-135. Возбудителю присуща высокая изменчивость: он подвергается L-трансформации с потерей капсулы, показывает гетероморфный рост, приобретает резистентность к химиопрепаратам.
Главным фактором патогенности менингококка считается эндотоксин — липоолигосахаридный комплекс, выделяющийся при разрушении микробной клетки. Возбудитель способен вырабатывать и ряд других повреждающих веществ (гемолизин, протеазы, гиалуронидазу), проникать сквозь гематоэнцефалический барьер. Фиксация к назофарингеальному эпителию происходит благодаря ресничкам, а капсула защищает бактерию от механизмов фагоцитоза.
Предрасположенность к развитию менингококкового менингита формируется в условиях снижения местной и общей резистентности организма. Факторами риска признаются врожденный дефицит комплемента, ВИЧ-инфекция, анатомическая или функциональная аспления. Слизистая оболочка носоглотки повреждается при курении и ОРВИ, что повышает риск бактериальной инвазии. Распространению инфекции способствует большая скученность населения.
Патогенез
Передача возбудителя происходит воздушно-капельным путем от больных менингококковой инфекцией или бессимптомных носителей. Входными воротами становится слизистая носоглотки, где развивается первичный воспалительный процесс. В 10-20% случаев микробы, преодолев защитные механизмы, проникают в кровоток, где размножаются, инициируя кратковременную бактериемическую фазу. В субарахноидальные пространства головного мозга нейссерии заносятся гематогенным путем, реже — лимфогенно, периваскулярно и периневрально через пластинку решетчатой кости.
При размножении менингококка развивается вначале серозно-гнойное, затем гнойное воспаление мягкой и паутинной оболочек. Чаще всего поражаются конвекситальные поверхности и основание головного мозга, иногда процесс распространяется в спинальном направлении. Макроскопически мягкая оболочка выглядит отечной, гиперемированной, мутной, поверхность мозга будто покрыта шапочкой из гноя. Микроскопическая картина представлена выраженной инфильтрацией полиморфноядерными мононуклеарными клетками. Спаечный процесс может вызвать закупорку путей ликворооттока.
Классификация
Согласно клинической классификации менингококковой инфекции, менингит относится к ее генерализованным формам. С учетом выраженности патологического процесса инфекция может протекать в легкой, среднетяжелой, тяжелой или крайне тяжелой формах. Менингит, вызванный N. meningitidis, является гнойным. Клинически он представлен следующими вариантами:
- Классический. Инфекционный процесс имеет изолированный характер, поражаются только мягкая и паутинная оболочки головного мозга.
- Смешанный. Картина менингита дополняется признаками воспаления мозгового вещества (менингоэнцефалита), бактериемией (менингококцемией).
- Осложненный. Сопровождается развитием локальных и системных осложнений, обусловленных влиянием воспалительных изменений или токсинов возбудителя.
По длительности патологический процесс бывает острым (до 3 месяцев), затяжным (до полугода), хроническим (свыше 6 месяцев). В зависимости от локализации пораженных церебральных структур менингит подразделяется на конвекситальный (большие полушария), базальный (нижняя поверхность) и спинальный. Дополнительно выделяют ограниченную и тотальную формы.
Симптомы менингококкового менингита
Началу болезни обычно предшествует назофарингит, но симптомы могут возникнуть внезапно, на фоне полного благополучия. С большим постоянством в клинической картине обнаруживают так называемую менингеальную триаду — головные боли, лихорадку, рвоту. Температура резко поднимается до 40-42° C, сопровождается сильным ознобом. Мучительные головные боли носят диффузный давяще-распирающий или пульсирующий характер, локализуются преимущественно в лобно-теменной области, усиливаются в ночное время, при перемене положения головы, действии внешних раздражителей.
Рвота при менингококковом менингите возникает без предшествующей тошноты, «фонтаном», не приносит облегчения. Клиническая картина дополняется кожной гиперестезией, повышением чувствительности к звуковым, световым и болевым стимулам, запахам. Иногда уже в первые часы болезни возникают тонико-клонические судороги. Важное место в структуре общемозговых симптомов занимает психомоторное возбуждение и нарастающие расстройства сознания — от оглушения до комы.
Среди объективных симптомов на первое место выходят менингеальные знаки, которые появляются в самом начале заболевания и быстро прогрессируют. Наиболее постоянными являются ригидность затылочных мышц, симптомы Кернига и Брудзинского (верхний, средний, нижний). У детей отмечают признак Лесажа, выбухание и пульсацию родничка. Пациент принимает вынужденную позу — лежа на боку с запрокинутой назад головой и подтянутыми к животу коленями. Выраженность менингеального синдрома может не соответствовать тяжести патологии.
При неврологическом осмотре часто выявляют асимметрию сухожильных и кожных рефлексов, ослабляющихся по мере нарастания интоксикации, патологические стопные знаки. Базальные менингиты сопровождаются поражением черепных нервов, особенно III, IV, VII, VIII пар. Наличие стойкого красного дермографизма говорит о сопутствующих вегетативных расстройствах. Признаками интоксикации являются вначале тахикардия, а затем относительная брадикардия, гипотония, приглушенность сердечных тонов. У пациентов учащается дыхание, язык обложен грязно-коричневым налетом, сухой.
Осложнения
Крайне неблагоприятным вариантом является молниеносное течение болезни с отеком-набуханием головного мозга. Ситуация угрожает вклинением стволовых структур в большое затылочное отверстие черепа, что ведет к нарушению витальных функций. Медленное разрешение гнойного воспаления опасно развитием гидроцефалии, у детей младшего возраста могут возникать церебральная гипотония, субдуральный выпот.
Результатом тяжелых или сочетанных форм менингококкового менингита становятся инфекционно-токсический шок, острая надпочечниковая недостаточность. При запоздалом или неадекватном лечении гнойный процесс переходит на эпендиму желудочков и мозговое вещество, осложняясь вентрикулитом (эпендиматитом), энцефалитом. В поздние сроки отмечается риск глухоты, эпилепсии, задержки психомоторного развития у детей.
Диагностика
Установить происхождение менингококкового менингита на основании клинических данных удается при его сочетании с бактериемией. На вероятную этиологию изолированных форм болезни косвенно указывает эпидемиологическая и анамнестическая информация (наличие назофарингита, контакт с больным). Точную верификацию патологии обеспечивают лабораторно-инструментальные методы:
- Клинические анализы. Гемограмма показывает выраженный лейкоцитоз со сдвигом формулы влево, анэозинофилию, ускорение СОЭ. В спинномозговой жидкости отмечается полиморфноядерный плеоцитоз, снижение концентрации глюкозы, повышение белка. Изменения в анализе мочи неспецифичны, свидетельствуют о токсических явлениях.
- Бактериоскопия и посев. Менингококки выявляются в нейтрофилах при прямой бактериоскопии окрашенных по Граму мазков. Посев ликвора на сывороточный агар или другие питательные среды дает возможность уточнить культуральные, ферментные, антигенные свойства возбудителя, определить его чувствительность к антибиотикам.
- Серологические тесты. После выделения менингококка идентифицировать его по серогруппам можно при постановке реакции агглютинации. Для обнаружения антител в крови применяют РНГА, экспресс-диагностику проводят с помощью ИФА, методов встречного иммуноэлектрофореза.
- Молекулярно-генетический анализ. В дополнение к стандартным процедурам используют ПЦР, позволяющую выявить бактериальную ДНК. Это быстрый и чувствительный диагностический тест. Особую ценность он приобретает при невозможности выделить возбудителя из ликвора или крови.
- Нейровизуализация. Показаниями для церебральной томографии могут быть нарушения сознания, очаговые неврологические симптомы. КТ головного мозга подтверждает ликворную гипертензию, внутримозговые кровоизлияния, церебральный отек. МРТ с контрастированием предпочтительнее, так как лучше визуализирует менингеальную оболочку, субарахноидальное пространство.
В качестве дополнительного исследования при судорогах для регистрации биоэлектрической активности мозга назначают ЭЭГ. Помощь в диагностическом поиске оказывают офтальмолог (осмотр глазного дна), инфекционист. Заболевание необходимо дифференцировать с менингитами иной этиологии, эпидуральным абсцессом, субдуральной эмпиемой. Следует исключать энцефалиты, острый рассеянный энцефаломиелит, субарахноидальную гематому.
Лечение менингококкового менингита
Любые формы генерализованной инфекции сопряжены с высокой опасностью летального исхода и тяжелых осложнений. Поэтому менингококковый менингит должен рассматриваться как неотложное состояние, требующее срочной госпитализации в профильный стационар. Обычно пациенты сразу попадают в палату интенсивной терапии под круглосуточное наблюдение специалистов. Им показан строгий постельный режим. Основой лечения является фармакотерапия:
- Этиотропная. Центральное место отводится антибиотикотерапии препаратами пенициллинового (бензилпенициллином, ампициллином) или цефалоспоринового ряда (цефтриаксоном, цефотаксимом). Альтернативными медикаментами выступают карбапенемы, хлорамфеникол. Сначала назначается эмпирическая терапия, которая затем корректируется с учетом данных антибиотикочувствительности.
- Патогенетическая. Для купирования отека головного мозга используются глюкокортикоиды, осмотические и петлевые диуретики (маннитол, фуросемид). Гемодинамическая нестабильность и токсикоз требуют инфузионной поддержки (кристаллоидами, коллоидами, плазмой), введения вазопрессоров, оксигенотерапии. В тяжелых случаях проводят экстракорпоральную детоксикацию.
- Симптоматическая. В комплексном лечении менингококкового менингита применяют симптоматические препараты. При судорожной активности показаны антиконвульсанты (диазепам, натрия оксибутират). Высокую лихорадку купируют жаропонижающими средствами.
Выписка из стационара осуществляется при полном клиническом выздоровлении. Все пациенты, перенесшие менингококковый менингит, должны находиться под диспансерным наблюдением невролога с прохождением регулярного обследования. Последствия и остаточные явления устраняются комплексной реабилитацией, которая включает физиотерапию, лечебную гимнастику, когнитивную коррекцию.
Прогноз и профилактика
При своевременной специфической терапии менингококкового менингита прогноз относительно благоприятный, сочетанные и осложненные формы существенно ухудшают исход. Генерализованная инфекция всегда сопряжена с риском жизнеугрожающих состояний — даже на фоне лечения уровень летальности составляет 10-15%. Плохими прогностическими факторами считают очаговую неврологическую симптоматику, нарушение сознания, лабораторные сдвиги (анемию, тромбоцитопению, лейкопению).
Профилактика подразумевает воздействие на все звенья эпидемического процесса. В отношении источника инфекции проводят раннее выявление, изоляцию и лечение больных, санацию носителей. Разорвать механизмы передачи помогают санитарно-гигиенические мероприятия, дезинфекция в очаге. Для создания специфического иммунитета у восприимчивых лиц рекомендуют вакцинацию против менингококковой инфекции. Повышению неспецифической резистентности способствует закаливание, своевременная терапия респираторных заболеваний.
Источник
Цефтриаксон инструкция по применению
Клинико-фармакологическая группа
Цефалоспорин III поколения
Действующее вещество
- цефтриаксон (в форме натриевой соли) (ceftriaxone)
Форма выпуска, состав и упаковка
Порошок для приготовления раствора для в/в и в/м введения кристаллический, почти белого или желтоватого цвета.
| 1 фл. | |
| цефтриаксон (в форме натриевой соли) | 1 г |
Флаконы стеклянные (1) — пачки картонные.
Фармакологическое действие
Полусинтетический цефалоспориновый антибиотик III поколения широкого спектра действия.
Бактерицидная активность цефтриаксона обусловлена подавлением синтеза клеточных мембран. Препарат отличается большой устойчивостью к действию бета-лактамаз (пенициллиназы и цефалоспориназы) грамположительных и грамотрицательных микроорганизмов.
Цефтриаксон активен в отношении грамотрицательных аэробных микроорганизмов: Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Haemophilus influenzae (в т.ч. штаммы, устойчивые к ампициллину), Haemophilus parainfluenzae, Klebssiella spp. (в т.ч. Klebssiella pneumoniae), Neisseria gonorrhoeae (в т.ч. штаммы, образующие и необразующие пенициллиназу), Neisseria meningitidis, Proteus mirabilis, Proteus vulgaris, Morganella morganii, Serratia marcescens, Citrobacter freundii, Citrobacter diversus, Providencia spp., Salmonella spp., Shigella spp., Acinetobacter calcoaceticus.
Ряд штаммов вышеперечисленных микроорганизмов, которые проявляют устойчивость к другим антибиотикам, таким как пенициллины, цефалоспорины, аминогликозиды, чувствительны к цефтриаксону.
Отдельные штаммы Pseudomonas aeruginosa также чувствительны к препарату.
Препарат активен в отношении грамположительных аэробных микроорганизмов: Staphylococcus aureus (в т.ч. штаммы, образующие пенициллиназу), Staphylococcus epidermidis (стафилококки, устойчивые к метициллину, проявляют устойчивость ко всем цефалоспоринам, включая цефтриаксон), Streptococcus pyogenes (бета-гемолитические стрептококки группы A), Streptococcus agalactiae (стрептококки группы В), Streptococcus pneumoniae; анаэробных микроорганизмов: Bacteroides spp., Clostridium spp. (за исключением Clostridium difficile).
Фармакодинамика
Цефтриаксон — парентеральный цефалоспориновый антибиотик III поколения. Бактерицидная активность цефтриаксона обусловлена подавлением синтеза клеточной стенки. In vitro цефтриаксон обладает широким спектром действия в отношении грамотрицательных и грамположительных микроорганизмов. Он высокоустойчив к большинству β‑лактамаз (как пенициллиназ, так и цефалоспориназ), вырабатываемых грамположительными и грамотрицательными бактериями.
Цефтриаксон обычно активен в отношении следующих микроорганизмов.
Грамположительные аэробы
Staphylococcus aureus (метициллиночувствительный), коагулазо-отрицательные стафилококки, Streptococcus pyogenes (β‑гемолитический, группы A), Streptococcus agalactiae (β‑гемолитический, группы B), β‑гемолитические стрептококки (группы ни A, ни B), Streptococcus viridans, Streptococcus pneumoniae.
Примечание. Метициллиноустойчивые Staphylococcus spp. резистентны к цефалоспоринам, в том числе к цефтриаксону. Как правило, Enterococcus faecalis, Enterococcus faecium и Listeria monocytogenes также устойчивы.
Грамотрицательные аэробы
Acinetobacter lwoffii, Acinetobacter anitratus (главным образом, A. baumannii)*, Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, алкалигеноподобные бактерии, Borrelia burgdorferi, Capnocytophaga spp., Citrobacter diversus (в том числе C. amalonaticus), Citrobacter freundii*, Escherichia coli, Enterobacter aerogenes*, Enterobacter cloacae*, Enterobacter spp. (прочие)*, Haemophilus ducreyi, Haemophilus influenzae, Haemophilus parainfluenzae, Hafnia alvei, Klebsiella oxytoca, Klebsiella pneumoniae**, Moraxella catarrhalis (ранее называвшаяся Branhamella catarrhalis), Moraxella osloensis, Moraxella spp. (прочие), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri*, Proteus vulgaris*, Pseudomonas fluorescens*, Pseudomonas spp. (прочие), Providencia rettgeri*, Providencia spp. (прочие), Salmonella typhi, Salmonella spp. (нетифоидные), Serratia marcescens*, Serratia spp. (прочие)*, Shigella spp., Vibrio spp., Yersinia enterocolitica, Yersinia spp. (прочие).
* Некоторые изоляты этих видов устойчивы к цефтриаксону, главным образом, вследствие образования β‑лактамаз, кодируемых хромосомами.
** Некоторые изоляты этих видов устойчивы вследствие образования целого ряда плазмидо-опосредованных β‑лактамаз.
Примечание. Многие штаммы вышеуказанных микроорганизмов, полирезистентные к другим антибиотикам, таким как аминопенициллины и уреидопенициллины, цефалоспорины первого и второго поколения и аминогликозиды, чувствительны к цефтриаксону. Treponema pallidum чувствительна к цефтриаксону in vitro и в экспериментах на животных. Клинические испытания показывают, что цефтриаксон обладает хорошей эффективностью в отношении первичного и вторичного сифилиса. За очень небольшими исключениями, клинические изоляты Р. aeruginosa устойчивы к цефтриаксону.
Анаэробы
Bacteroides spp. (желчечувствительные)*, Clostridium spp. (кроме С. difficile), Fusobacterium nucleatum, Fusobacterium spp. (прочие), Gaffkya anaerobica (ранее называвшаяся Peptococcus), Peptostreptococcus spp.
* Некоторые изоляты этих видов устойчивы к цефтриаксону из-за образования β‑лактамаз.
Примечание. Многие штаммы β‑лактамазообразующих Bacteroides spp. (в частности, В. fragilis) устойчивы. Устойчив и Clostridium difficile.
Чувствительность к цефтриаксону можно определять диско-диффузионным методом или методом серийных разведений на агаре или бульоне, используя стандартную методику, подобную той, которую рекомендует Институт клинических и лабораторных стандартов (ИКЛС). ИКЛС установил следующие критерии оценки результатов пробы для цефтриаксона:
| Чувствительны | Умеренно чувствительны | Устойчивы | |
| Метод разведений | |||
| Подавляющая концентрация, мг/л | = 8 | 16-32 | = 64 |
| Метод дисков (диск с 30 мкг цефтриаксона) | |||
| Диаметр зоны задержки роста, мм | = 21 | 20-14 | = 13 |
Для определения следует брать диски с цефтриаксоном, так как в исследованиях in vitro показано, что цефтриаксон активен в отношении отдельных штаммов, которые обнаруживают устойчивость при использовании дисков, предназначенных для всей группы цефалоспоринов.
Вместо стандартов ИКЛС для определения чувствительности микроорганизмов можно использовать и другие хорошо стандартизованные нормативы, например, Немецкого института стандартизации DIN (Deutsches Institut fur Normung) и международные рекомендации ICS (International Collaborative Study), позволяющие адекватно интерпретировать состояние чувствительности.
Фармакокинетика
Всасывание
При в/м введении цефтриаксон хорошо абсорбируется из места введения и достигает высоких концентраций в сыворотке. Биодоступность препарата — 100 %.
Средняя концентрация в плазме достигается через 2-3 ч после инъекции. При повторном в/м или в/в введении в дозах 0.5-2.0 г с интервалом 12-24 ч происходит накопление цефтриаксона в концентрации, которая на 15-36% превышает концентрацию, достигаемую при однократном введении.
Распределение
При введении в дозе от 0.15 до 3.0 г Vd — от 5.78 до 13.5 л .
Цефтриаксон обратимо связывается с белками плазмы крови.
Выведение
При введении в дозе от 0.15 до 3.0 г Т1/2 составляет от 5.8 до 8.7 ч; плазменный клиренс — 0.58 — 1.45 л/ч, почечный клиренс — 0.32 — 0.73 л/ч.
От 33% до 67% препарата выводится в неизменном виде почками, остальная часть экскретируется с желчью в кишечник, где биотрансформируется в неактивный метаболит.
Фармакокинетика в особых клинических случаях
У новорожденных и у детей при воспалении мозговой оболочки цефтриаксон проникает в ликвор, при этом в случае бактериального менингита в среднем 17% от концентрации препарата в плазме диффундирует в спинномозговую жидкость, что примерно в 4 раза больше, чем при асептическом менингите. Через 24 ч после в/в введения цефтриаксона в дозе 50 — 100 мг/кг массы тела концентрации в спинномозговой жидкости превышают 1.4 мг/л. У взрослых больных менингитом через 2-24 ч после введения дозы 50 мг/кг массы тела, концентрации цефтриаксона в спинномозговой жидкости во много раз превосходят минимальные подавляющие концентрации для самых распространенных возбудителей менингита.
Показания
Лечений инфекций, вызванных чувствительными к микроорганизмами:
- сепсис;
- менингит;
- диссеминированный боррелиоз Лайма (ранние и поздние стадии заболевания);
- инфекции органов брюшной полости (перитонит, инфекции желчных путей и желудочно-кишечного тракта);
- инфекции костей и суставов;
- инфекции кожи и мягких тканей;
- раневые инфекции;
- инфекции у больных с ослабленным иммунитетом;
- инфекции органов малого таза;
- инфекции почек и мочевыводящих путей;
- инфекции дыхательных путей (особенно пневмония);
- инфекции ЛОР-органов;
- инфекции половых органов, включая гонорею.
Профилактика инфекций в послеоперационном периоде.
Противопоказания
- повышенная чувствительность к цефтриаксону и другим цефалоспоринам, пенициллинам, карбапенемам.
С осторожностью назначают препарат при НЯК, при нарушениях функции печени и почек, при энтерите и колите, связанных с применением антибактериальных препаратов; недоношенным и новорожденным детям с гипербилирубинемией.
Дозировка
Препарат вводят в/м или в/в.
Взрослым и детям в возрасте старше 12 лет назначают по 1-2 г 1 раз/сут (каждые 24 ч). В тяжелых случаях или при инфекциях, возбудители которых обладают лишь умеренной чувствительностью к цефтриаксону, суточную дозу можно увеличить до 4 г.
Новорожденным (до 2 недель) назначают по 20-50 мг/кг массы тела 1 раз/сут. Суточная доза не должна превышать 50 мг/кг массы тела. При определении дозы не следует делать различия между доношенными и недоношенными детьми.
Грудным детям и детям младшего возраста (с 15 дней до 12 лет) назначают по 20-80 мг/кг массы тела 1 раз/сут.
Детям с массой тела >50 кг назначают дозы, предназначенные для взрослых.
Дозы 50 мг/кг и более для в/в введения следует вводить капельно в течение не менее 30 мин.
Пациентам старческого возраста следует вводить обычные дозы, предназначенные для взрослых, без поправок на возраст.
Продолжительность лечения зависит от течения заболевания. Введение Цефтриаксона следует продолжать больным еще в течение минимум 48-72 ч после нормализации температуры и подтверждения эрадикации возбудителя.
При бактериальном менингите у грудных детей и детей младшего возраста лечение начинают с дозы 100 мг/кг (но не более 4 г) 1 раз/сут. После идентификации возбудителя и определения его чувствительности дозу можно соответственно уменьшить.
При менингококковом менингите наилучшие результаты достигались при продолжительности лечения 4 дня, при менингите, вызванном Haemophilus influenzae, — 6 дней, Streptococcus pneumoniae, — 7 дней.
При боррелиозе Лайма: взрослым и детям старше 12 лет назначают по 50 мг/кг 1 раз в сутки в течение 14 дней; максимальная суточная доза — 2 г.
При гонорее (вызванной штаммами, образующими и необразующими пенициллиназу) — однократно в/м в дозе 250 мг.
С целью профилактики послеоперационных инфекций в зависимости от степени инфекционного риска препарат вводят в дозе 1-2 г однократно за 30-90 мин до начала операции.
При операциях на толстой и прямой кишке — эффективно одновременное (но раздельное) введение Цефтриаксона и одного из 5-нитроимидазолов, например, орнидазола.
У больных с нарушением функции почек нет необходимости уменьшать дозу, если функция печени остается нормальной. В случаях претерминальной почечной недостаточности тяжелой степени с КК<10 мл/мин суточная доза препарата не должна превышать 2 г.
У больных с нарушением функции печени нет необходимости уменьшать дозу, если функция почек остается нормальной.
При сочетании тяжелой почечной и печеночной недостаточности следует регулярно определять концентрацию цефтриаксона в плазме и при необходимости корректировать его дозу.
Больным, находящимся на диализе дополнительного введения препарата после диализа не требуется. Следует, однако, контролировать концентрацию цефтриаксона в сыворотке с целью своевременной коррекции дозы, поскольку скорость выведения препарата у этих больных может снижаться.
Правила приготовления и введения растворов
Для в/м введения
Содержимое флакона (1 г) растворяют в 3.6 мл воды для инъекций. После приготовления в 1 мл раствора содержится около 250 мг цефтриаксона. При необходимости можно использовать более разбавленный раствор.
Как и при других в/м инъекциях, Цефтриаксон вводят в относительно крупную мышцу (ягодичную); пробная аспирация помогает избежать непреднамеренного введения в кровеносный сосуд. Рекомендуется вводить не более 1 г препарата в одну мышцу. Для уменьшения боли при в/м инъекциях препарат следует вводить с 1% раствором лидокаина. Нельзя вводить раствор лидокаина в/в.
Для в/в введения
Содержимое флакона (1 г) растворяют в 9.6 мл воды для инъекций. После приготовления в 1 мл раствора содержится около 100 мг цефтриаксона. Раствор вводят медленно в течение 2-4 мин.
Для в/в инфузии
Растворяют 2 г Цефтриаксона в 40 мл стерильной воды для инъекций или одного из инфузионных растворов, не содержащих кальция (0.9 % раствор натрия хлорида, 2.5 %, 5 % или 10 % раствор декстрозы, 5 % раствор левулозы, 6 % раствор декстрана в декстрозе). Раствор вводят в течение 30 мин.
Побочные действия
Аллергические реакции: крапивница, озноб или лихорадка, сыпь, зуд; редко — бронхоспазм, эозинофилия, экссудативная многоформная эритема (в т.ч. синдром Стивенса-Джонсона), сывороточная болезнь, анафилактический шок.
Со стороны пищеварительной системы: тошнота, рвота, диарея или запор, метеоризм, абдоминальные боли, нарушение вкуса, стоматит, глоссит, псевдомембранозный энтероколит, нарушение функции печени (повышение активности печеночных трансаминаз, реже — ЩФ или билирубина, холестатическая желтуха), псевдохолелитиаз желчного пузыря («sludge»-синдром), дисбактериоз.
Со стороны системы кроветворения: анемия, лейкопения, лейкоцитоз, нейтропения, гранулоцитопения, лимфопения, тромбоцитоз, тромбоцитопения, гемолитическая анемия, гипокоагуляция, снижение концентрации пламенных факторов свертывания крови (II, VII, IX, X), удлинение протромбинового времени.
Со стороны мочевыделительной системы: нарушение функции почек (азотемия, повышение содержания мочевины в крови, гиперкреатининемия, глюкозурия, цилиндрурия, гематурия), олигурия, анурия.
Местные реакции: флебит, болезненность по ходу вены, болезненность и инфильтрат в месте в/м введения.
Прочие: головная боль, головокружение, носовые кровотечения, кандидоз, суперинфекция.
Передозировка
При передозировке гемодиализ и перитонеальный диализ не снижают концентрации препарата. Специфического антидота нет.
Лечение передозировки симптоматическое.
Лекарственное взаимодействие
Цефтриаксон, подавляя кишечную флору, препятствует синтезу витамина К.
При одновременном назначении с препаратами, снижающими агрегацию тромбоцитов (НПВС, салицилаты, сульфинпиразон), увеличивается риск развития кровотечений. При одновременном назначении с антикоагулянтами отмечается усиление действия последних.
При одновременном назначении с «петлевыми» диуретиками возрастает риск развития нефротоксического действия.
Цефтриаксон и аминогликозиды обладают синергизмом в отношении многих грамотрицательных бактерий.
Несовместим с этанолом.
Фармацевтическое взаимодействие
Растворы цефтриаксона не следует смешивать или вводить одновременно с другими противомикробными препаратами. Цефтриаксон нельзя смешивать с растворами, содержащими кальций.
Особые указания
При одновременной тяжелой почечной и печеночной недостаточности, у больных, находящихся на гемодиализе, следует регулярно определять концентрацию препарата в плазме.
При длительном лечении необходимо регулярно контролировать картину периферической крови, показатели функционального состояния печени и почек.
В редких случаях при УЗИ желчного пузыря отмечаются затемнения, которые исчезают после прекращения лечения (даже если это явление сопровождается болями в правом подреберье, рекомендуется продолжение назначения антибиотика и проведение симптоматического лечения).
Во время лечения нельзя употреблять алкоголь, поскольку возможны дисульфирамоподобные эффекты (покраснение лица, спазм в животе и в области желудка, тошнота, рвота, головная боль, снижение АД, тахикардия, одышка).
Несмотря на подробный сбор анамнеза, что является правилом и для других цефалоспориновых антибиотиков, нельзя исключить возможность развития анафилактического шока, который требует немедленной терапии — сначала в/в вводят эпинефрин, затем ГКС.
Исследования in vitro показали, что подобно другим цефалоспориновым антибиотикам, цефтриаксон способен вытеснять билирубин, связанный с альбумином сыворотки крови. Поэтому у новорожденных с гипербилирубинемией и, особенно у недоношенных новорожденных, применение Цефтриаксона требует еще большей осторожности.
Пожилым и ослабленным больным может потребоваться назначение витамина К.
Приготовленный раствор хранить при комнатной температуре не более 6 ч или в холодильнике при температуре 2-8° С не более 24 ч.
Беременность и лактация
Применение препарата при беременности возможно только в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода, т.к. цефтриаксон проникает через плацентарный барьер.
При необходимости применения препарата в период лактации следует решить вопрос о прекращении грудного вскармливания, т.к. цефтриаксон выделяется с грудным молоком.
При нарушениях функции почек
С осторожностью назначают препарат при нарушениях функции почек.
При одновременной тяжелой почечной и печеночной недостаточности, у больных, находящихся на гемодиализе, следует регулярно определять концентрацию препарата в плазме.
При длительном лечении необходимо регулярно контролировать показатели функционального состояния почек.
При нарушениях функции печени
При одновременной тяжелой почечной и печеночной недостаточности, у больных, находящихся на гемодиализе, следует регулярно определять концентрацию препарата в плазме.
При длительном лечении необходимо регулярно контролировать показатели функционального состояния печени.
В редких случаях при УЗИ желчного пузыря отмечаются затемнения, которые исчезают после прекращения лечения (даже если это явление сопровождается болями в правом подреберье, рекомендуется продолжение назначения антибиотика и проведение симптоматического лечения).
Условия отпуска из аптек
Препарат отпускается по рецепту.
Условия и сроки хранения
Препарат следует хранить в недоступном для детей, сухом, защищенном от света месте при температуре не выше 25°С. Срок годности — 3 года.
Источник