Среда для выделения коклюша
Содержание статьи
ордетелла — Ф. К. Черкес [1986 Черкес Ф.К., Богоявленская Л.Б., Бельская Н.А.
Бордетелла — Ф. К. Черкес
Глава 31. Возбудители коклюша и паракоклюша
Возбудители этих заболеваний относятся к роду Bordetella.
1. Bordetella pertussis — возбудитель коклюша, описан Борде и Жангу в 1906 г.
2. Bordetella parapertussis — возбудитель паракоклюша, описан Элдеринг и Кондрик в 1937 г.
3. Bordetella bronchiseptica — вызывает заболевание у животных. У человека эти бактерии вызывают бронхопневмонию с коклюшеподобным кашлем. Впервые у человека это заболевание описано Брауном в 1926 г. (встречается редко).
Морфология. Бактерии коклюша — мелкие палочки овоидной формы, 0,3-0,5 × 1-1,5 мкм. Возбудитель пара-коклюша несколько большей величины. Оба микроба не имеют спор, неподвижны. При специальной окраске видна капсула. Грамотрицательны. Более интенсивно окрашиваются по полюсам.
На ультрасрезах видны капсулоподобная оболочка, зерна валютина, в нуклеиде — вакуоли.
Культивирование. Возбудители коклюша и паракоклюша — аэробы. Прихотливы к питательным средам. Для их выращивания применяют среду Борде — Жангу (глицериново-картофельный агар с кровью). В настоящее время пользуются средой КУА (казеиново-угольный агар) — это полусинтетическая среда без крови. Источником аминокислот здесь является гидролизат казеина. Среда КУА отличается от среды Борде — Жангу более простым и доступным методом изготовления.
Для угнетения роста посторонней флоры к среде добавляют пенициллин по 0,25 — 0,5 ME на 1 мл среды или метициллин — 2,5-4 мкг на 1 мл. Пенициллин можно наносить на поверхность среды в чашках.
Засеянные среды инкубируют в термостате при температуре 35-36° С, рН среды 6,8-7,4. Посевы необходимо предохранять от высыхания, для этого в термостат ставят сосуд с водой.
Колонии В. pertussis появляются через 48-72 ч, а В. parapertussis — через 24-48 ч.
На среде КУА колонии В. pertussis мелкие 1-2 мм в диаметре, В. parapertussis несколько крупнее. Колонии обоих микробов блестящие, серовато-кремового цвета (на казеиново-угольном агаре они напоминают капельки ртути). При снятии колоний остается вязкий, сметанообразный след. При изучении колоний в стереоскопическом микроскопе виден световой конус (колонии отбрасывают тень). Когда меняется положение светового источника (электролампочки) тень меняет положением Наличие светового конуса (хвостика) имеет диагностическое значение.
В. parapertussis образует фермент тирозиназу, поэтому в средах, содержащих тирозин, происходит его расщепление и среда окрашивается в коричневый цвет. Изменение цвета среды является дифференциально-диагностическим признаком.
В жидкой среде бактерии коклюша и паракоклюша образуют равномерную муть и придонный осадок. На агаре с кровью они дают зону гемолиза.
Свежевыделенные культуры чаще всего имеют гладкую S-форму (I фаза). При культивировании в неблагоприятных условиях или в материале, взятом в поздние сроки заболевания, могут появиться диссоциированные формы (II-IV фазы).
Ферментативные свойства. Возбудители коклюша не расщепляют углеводы и не ферментируют белки. Бактерии паракоклюша образуют ферменты уреазу и тирозиназу.
Бактерии коклюша и паракоклюша продуцируют ферменты патогенности: гиалуронидазу, плазмокоагулазу и лецитиназу.
Токсинообразование. В опытах на животных у коклюшной палочки были выявлены четыре типа токсина белковой природы: 1) термолабильный дермонекротический токсин; 2) термостабильный эндотоксин; 3) лейкоцитозостимулирующий фактор (стимулирующий лейкоцитоз); парентеральное введение его вызывало гибель экспериментальных животных; 4) гистаминсенсибилизирующий фактор — при введении его мышам у них повышалась чувствительность к гистамину.
Первые два типа токсина свойственны и возбудителю паракоклюша.

Таблица 47. Дифференциальные признаки бактерий рода Bordetella
Антигенная структура. У бактерий рода Bordetella сложная антиренная структура. Наиболее важными антигенами для лабораторной диагностики являются агглютиногены. Родовым агглютиногеном является 7. Видоспецифическим агглютиногеном для бордетелл коклюша является 1, для бордетелл паракоклюша — 14, для бордетелл бронхосептика — 12.
Моноспецифические сыворотки 1, 14, 12 используются для дифференциации видов (сыворотки выпускает Институт эпидемиологии и микробиологии им. Н. Ф. Гамалеи).
Кроме видоспецифических антигенов, у представителей Bordetella имеются и другие агглютиногены, разное сочетание которых определяет серовар (табл. 48.).

Таблица 48. Схема состава агглютиногенного рода бордетелл
По сочетанию трех главных агглютиногенов 1,2,3, определяемых в реакции агглютинации с моноспецифическими сыворотками, В. pertussis различают три серовара: 1,2,3; 1,2,0; 1,0,3.
Устойчивость к факторам окружающей среды. Возбудители коклюша и паракоклюша мало устойчивы. При температуре 56° С они погибают через 20-30 мин. Низкие температуры также губительно на них действуют. Прямой солнечный свет убивает их через 1-2 ч; УФ-лучи — через несколько минут. В сухой мокроте эти бактерии сохраняются в течение нескольких часов. Обычные растворы дезинфицирующих веществ губят их быстро.
Оба вида микробов мало чувствительны к антибиотикам, не чувствительны к пенициллину.
Восприимчивость животных. В естественных условиях животные не восприимчивы к возбудителям этого рода. В экспериментальных условиях удается воспроизвести коклюш у обезьян и молодых собак, вызвать гибель мышей.
Источники инфекции. Больной человек. Особенно заразны больные в катаральном периоде.
Пути передачи. Воздушно-капельный путь. Роль различных предметов мало вероятна ввиду неустойчивости коклюшных бактерий во внешней среде.
Патогенез. Возбудители коклюша и паракоклюша вызывают острое заболевание, сопровождающееся конвульсивным кашлем. Попав на слизистую оболочку верхних дыхательных путей, бактерии размножаются там и частично разрушаются. Выделившийся токсин действует на центральную нервную систему, раздражает нервные рецепторы слизистой оболочки верхних дыхательных путей, что приводит в действие кашлевой рефлекс. В результате возникают приступы судорожного кашля. В процессе заболевания наблюдается несколько периодов: катаральный, спазматического кашля и разрешения процесса.
Иммунитет. После перенесенного заболевания вырабатывается стойкий иммунитет, который обусловливается гуморальными и клеточными факторами.
Профилактика. Выявление и изоляция больных. Ослабленным детям, находившимся в контакте с больным коклюшем, вводят иммуноглобулин. Основные меры специфической профилактики — иммунизация детей АКДС (коклюшно-дифтерийно-столбнячной вакциной). Вакцину вводят троекратно в возрасте до 6 мес с последующей ревакцинацией.
Лечение. В ранних стадиях заболевания применяют противококлюшный иммуноглобулин. Для лечения используют эритромицин и ампициллин.
Контрольные вопросы
1. Опишите морфологические свойства возбудителя коклюша и паракоклюша.
2. На каких средах и каков характер роста коклюшных и паракоклюшных микробов?
3. Устойчивость возбудителей коклюша и паракоклюша во внешней среде.
4. Дифференциальные признаки возбудителей коклюша и паракоклюша.
5. Источники заражения, пути передачи, патогенез коклюша.
Микробиологическое исследование
Цель исследования: выявление возбудителя и дифференциация возбудителей коклюша от паракоклюша.
Материал для исследования
Отделяемое слизистой оболочки носоглотки.
Способы сбора материала

Способы сбора материала
Основной метод исследования
Микробиологический
Ход исследования
Первый день исследования

Первый день исследования
Второй — третий дни исследования
Посевы вынимают из термостата и просматривают, пользуясь лупой или стереоскопическим бинокулярным микроскопом. При наличии подозрительных колоний их выделяют на КУА: в чашках Петри, разделенных на сектора, или в пробирках. Посевы ставят в термостат. Если колоний много, из части их можно сделать мазки, покрасить и посмотреть под микроскопом. При наличии мелких грамотрицательных палочек ставят пробную реакцию агглютинации с моноспецифической родовой сывороткой 7. Положительная реакция агглютинации свидетельствует о принадлежности выделенной культуры к роду Bordetella. Для определения вида бордетелл ставят реакцию агглютинации с моноспецифическими видовыми сыворотками 1 и 14. Реакции ставят на предметном стекле. Положительный результат реакции агглютинации позволяет дать предварительный ответ.
Четвертый день исследования
Посевы вынимают из термостата и просматривают: сначала невооруженным глазом, обращая внимание на Цвет среды (нет ли коричневого окрашивания), затем изучают рост при помощи стереоскопического микроскопа.
При наличии подозрительных колоний из выделенной культуры делают мазки, окрашивают по Граму и изучают под микроскопом. Затем повторно (из чистой культуры) ставят реакцию агглютинации на стекле с моноспецифическими сыворотками 1,2,3 и 14. Результаты агглютинации дают возможность отдифференцировать В. pertussis от В. parapertussis, и если это — В. pertussis, то определить серовар: 1-й серовар — (1,2,3), 2-й серовар — (1,2,0), 3-й серовар — (1,0,3). Определение серовара имеет эпидемиологическое значение.
Для окончательной идентификации выделенной культуры (при положительной агглютинации с моноспецифическими сыворотками) ставят пробу на наличие уреазы и производят посев на скошенный агар, содержащий 0,1% тирозина (см. рис. 49).

Рис. 49. Схема выделения и идентификации возбудителей коклюша и паракоклюша (Bordetella pertussis и Bordetella parapertussis)
Проба на уреазу. В маленькую пробирку наливают 0,3-0,4 мл 2% раствора мочевины, вносят петлю культуры и добавляют 2-3 капли фенолфталеина. Пробирку встряхивают и ставят в термостат. Учитывают реакцию через 2 и 24 ч. Бактерии коклюша не изменяют цвет среды. Бактерии паракоклюша обладают ферментом уреазой, который расщепляют мочевину с образованием аммиака. Аммиак изменяет индикатор и среда окрашивается в красный цвет.
Проба с тирозином. На скошенный МПА в пробирках с 0,1% тирозином засевают выделенную культуру и ставят в термостат. На следующий день вынимают пробирку из термостата и просматривают ее. Наличие роста в пробирке и окрашивание среды в коричневый цвет свидетельствуют о росте возбудителей паракоклюша. Возбудители коклюша на этой среде не растут.
Пятый день исследования
При отсутствии подозрительных колоний дают отрицательный ответ.
Ускоренная диагностика
При бактериологическом методе исследования ответ можно получить через 3-4 дня.
1. Применение иммунно-люминесцентного метода позволяет дать ответ через несколько часов после взятия материала путем непосредственного выявления микробов в мазках, сделанных с тампонов.
2. Из посевов на среде КУА при отсутствии видимого роста можно сделать мазок-отпечаток: для этого стерильной резиновой пробкой дотрагиваются до места посева и переносят отпечаток на предметное стекло. Мазок-отпечаток изучают методом иммунофлюоресценции. В мазках обнаруживаются бактерии В. pertussis или В. parapertussis.
Контрольные вопросы
1. Что служит материалом для исследования при подозрении на коклюш?
2. Какие методы сбора материала применяют для выявления возбудителя при подозрении на коклюш?
3. Что прибавляют к среде для подавления роста посторонней микрофлоры?
Задание
1. Возьмите 10 чашек со средой КУА, флакон пенициллина, содержащий 300000 ЕД. Сделайте разведение пенициллина таким образом, чтобы в 0,1 мл содержалось 7,5 ЕД. Сделайте расчет на общее количество среды.
2. Соберите отделяемое носоглотки друг у друга и сделайте посев на среду КУА.
3. Возьмите у преподавателя чашку с культурой бактерий коклюша или паракоклюша, изучите характер колоний с помощью стереоскопического микроскопа. Подозрительные колонии посейте на сектор среды КУА (выделение чистой культуры).
4. Возьмите у преподавателя чистую культуру возбудителей коклюша или паракоклюша, выросшую на секторе среды КУА, и поставьте реакцию агглютинации с диагностической коклюшной сывороткой.
При наличии положительной реакции агглютинации поставьте пробу на уреазу и сделайте посев на среду с тирозином (0,1%).
Питательные среды
КУА. Среду готовит Институт эпидемиологии и микробиологии им. Н. Ф. Гамалея. Готовая среда КУА черного цвета, конденсационная вода не должна содержать частиц угля. В готовом виде среду можно сохранять продолжительное время (до месяца и более), предохраняя ее от высыхания.
Источник
Микробиология коклюша и паракоклюша
Микробиология коклюша и паракоклюша
Коклюш — острое инфекционное заболевание преимущественно детского возраста, характеризующееся циклическим течением и приступообразным спазматическим кашлем.
Возбудитель — Bordetella pertussis — впервые был обнаружен в 1900 г. в мазках из мокроты ребенка и затем выделен в чистой культуре в 1906 г. Ж. Борде и О. Жангу. Возбудитель сходного с коклюшем, но протекающего более легко заболевания — Bordetella parapertussis — был выделен и изучен в 1937 г. Г. Эльдерингом и П. Кендриком и независимо от них в 1937 г. У. Брэдфордом и Б. Славиным. Bordetella bronchiseptica, возбудитель редко встречающегося у человека коклюшеподобного заболевания, был выделен в 1911 г. у собак Н. Ферри, а у человека — в 1926 г. Брауном. В 1984 г. был выделен новый вид — Bordetella avium, патогенность которого для человека пока не установлена.
Бордетеллы относятся к классу Betaproteobacteria, грамотрицательны, хорошо окрашиваются всеми анилиновыми красителями. Иногда выявляется биполярная окраска за счет зерен волютина на полюсах клетки. Возбудитель коклюша имеет форму овоидной палочки (коккобактерии) размером 0,2 — 0,5 ? 1,0 — 1,2 мкм. Паракоклюш-
ная палочка имеет такую же форму, но несколько крупнее (0,6 ? 2 мкм). Расположены чаще поодиночке, но могут располагаться попарно. Спор не образуют, у молодых культур и у бактерий, выделенных из макроорганизма, обнаруживается капсула. Бордетеллы неподвижны, за исключением B. bronchiseptica, которая является перитрихом. Содержание Г + Ц в ДНК составляет 61 — 70 мол %. Относятся к гемофильным бактериям. Бордетеллы — строгие аэробы, хемоорганотрофы. Оптимальная температура роста — 35 — 36 °C. Возбудитель коклюша в гладкой S-форме (так называемая фаза I), в отличие от двух других видов бордетелл, не растет на МПБ и МПА, так как его размножению мешают накопление в среде ненасыщенных жирных кислот, образующихся в процессе роста, а также возникающая при росте коллоидная сера и другие продукты метаболизма. Для их нейтрализации (или адсорбции) в среду выращивания коклюшных бактерий необходимо добавлять крахмал, альбумин и древесный уголь или ионообменные смолы. Микроб требует наличия в среде выращивания 3 аминокислот — пролина, цистеина и глутаминовой кислоты, источником которых служат гидролизаты казеина или фасоли. Традиционная среда для выращивания коклюшной палочки — среда Борде — Жангу (картофельно-глицериновый агар с добавлением крови), на ней она растет в виде гладких, блестящих, прозрачных куполообразных с жемчужным или металлическим ртутным оттенком колоний диаметром около 1 мм, которые вырастают на 3 — 4-й день. На другой среде — казеиново-угольном агаре (КУА) — также на 3 — 4-й день вырастают гладкие выпуклые колонии диаметром около 1 мм, имеющие серовато-кремовый цвет и вязкую консистенцию. Колонии паракоклюшных бактерий по внешнему виду не отличаются от коклюшных, но крупнее и выявляются на 2 — 3-й день, а колонии B. bronchiseptica выявляются уже на 1 — 2-й день.
Характерной особенностью коклюшных бактерий является их наклонность к быстрому изменению культуральных и серологических свойств при изменении состава питательной среды, температуры и других условий выращивания. В процессе перехода от S-формы (фаза I) к стабильной шероховатой R-форме (фаза IV) через промежуточные фазы II и III наблюдаются плавные изменения антигенных свойств;
патогенные свойства теряются.
Паракоклюшные бактерии и B. bronchiseptica, а также фазы II, III и IV коклюшных бактерий растут на МПА и МПБ. При выращивании на жидкой среде наблюдается диффузное помутнение с придонным плотным осадком; клетки могут быть несколько крупнее и полиморфными, иногда образуют нити. В R-форме и промежуточных формах бактерии проявляют выраженный полиморфизм.
На среде Борде — Жангу все бордетеллы образуют вокруг колоний нерезко ограниченную зону гемолиза, распространяющуюся диффузно в среду.
Бордетеллы не ферментируют углеводов, не образуют индола, не восстанавливают нитраты в нитриты (за исключением B. bronchiseptica). Паракоклюшные бактерии выделяют тирозиназу, образуя пигмент, окрашивающий среду и культуру в коричневый цвет. Дифференциальные признаки бордетелл приведены в табл. 46.
Бордетеллы содержат несколько антигенных комплексов. Соматический О-антиген видоспецифичен (см. табл. 43); родовым антигеном является агглютиноген 7. Главные агглютиногены у возбудителя коклюша — 7-й (родовой), 1-й (видовой) и наиболее часто обнаруживаемые типоспецифические 2-й и 3-й. В зависимости от их сочетания у Bordetella pertussis выделяют четыре сероварианта: 1, 2, 3; 1, 2, 0; 1, 0, 3 и 1, 0, 0.
Факторы патогенности. Фимбрии (агглютиногены), белок наружной мембраны пертактин (69 кД) и филаментозный гемагглютинин (поверхностный белок) отвечают за адгезию возбудителя на цилиарном эпителии средних отделов респираторного тракта (трахея, бронхи). Капсула защищает от фагоцитоза. Часто присутствуют гиалуронидаза, лецитиназа, плазмокоагулаза, аденилатциклаза. В составе эндотоксина
Таблица 46
Дифференциальные признаки бордетелл
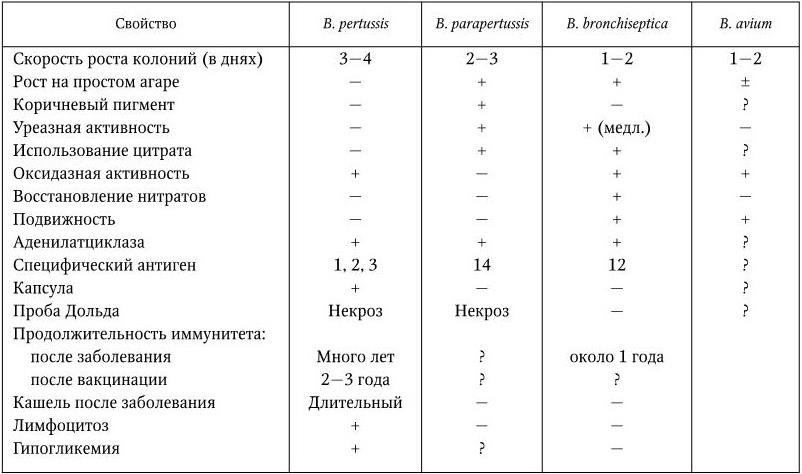
Примечание. (+) — признак положительный; ( — ) — признак отрицательный; (±) — признак иногда положительный, иногда отрицательный; (?) — нет данных.
(ЛПС) два липида: А и Х. Биологическая активность ЛПС определяется липидом Х, липид А обладает низкой пирогенностью и нетоксичен. ЛПС обладает иммуногенностью (цельноклеточная вакцина), но вызывает сенсибилизацию. Имеются три экзотоксина. Коклюшный токсин (117 кД) по структуре и функции подобен холерогену, проявляет активность АДФ-рибозилтрансферазы (рибозилирует трансдуцин — белок мембраны клетки-мишени, являющийся частью системы, ингибирующей клеточную аденилатциклазу), сильный иммуноген, повышает лимфоцитоз и выработку инсулина. Трахеальный цитотоксин представляет собой фрагмент пептидогликана, обладает пирогенностью, артритогенностью, индуцирует медленноволновой сон и стимулирует продукцию IL-1, в ответ на который синтезируется оксид азота (цитотоксический фактор). Повреждает эпителиальные клетки трахеи и вызывает цилиостаз. Термолабильный дермонекротоксин обладает нейротропностью, сосудосуживающей активностью, гомологичен цитотоксическому некротизирующему фактору 1 (CNF1) кишечной палочки. Мишенью его являются Rho-белки мембран клеток. Обнаруживают дермонекротоксин внутрикожной пробой на кроликах (проба Дольда).
Эпидемиология. Источник инфекции при коклюше и паракоклюше — больной типичной или стертой формой, особенно в период до появления спазматического кашля. При коклюшеподобном заболевании, вызванном B. bronchiseptica, источником инфекции могут быть домашние и дикие животные, среди которых иногда наблюдаются эпизоотии (свиньи, кролики, собаки, кошки, крысы, морские свинки, обезьяны), при этом чаще всего у животного поражается респираторный тракт. Механизм заражения — воздушно-капельный. Бордетеллы обладают специфическим тропизмом к цилиарному эпителию респираторного тракта хозяина. К инфекции восприимчивы люди всех возрастов, но более всего дети от 1 года до 10 лет.
Патогенез и клиника. Инкубационный период при коклюше от 3 до 14 дней, чаще 5 — 8 дней. Возбудитель, попавший на слизистую оболочку верхних дыхательных путей, размножается в клетках цилиарного эпителия и далее бронхогенным путем распространяется в более низкие отделы (бронхиолы, альвеолы, мелкие бронхи). При действии экзотоксина эпителий слизистой оболочки некротизируется, в результате чего раздражаются кашлевые рецепторы и создается постоянный поток сигналов в кашлевой центр продолговатого мозга, в котором формируется стойкий очаг возбуждения. Это приводит к возникновению спазматических приступов кашля. Бактериемии при коклюше не бывает. Вторичная бактериальная флора может приводить к осложнениям.
В течении заболевания выделяют следующие стадии: 1) катаральный период, длящийся около 2 нед. и сопровождающийся сухим кашлем; состояние больного постепенно ухудшается; 2) конвульсивный (судорожный), или спазматический, период, длящийся до 4 — 6 нед. и характеризующийся возникающими до 20 — 30 раз в сутки приступами неукротимого «лающего» кашля, причем приступы могут быть спровоцированы даже неспецифическими раздражителями (свет, звук, запах, медицинские манипуляции, осмотр и т. д.); 3) период разрешения, когда приступы кашля становятся реже и все менее продолжительными, отторгаются некротизированные участки слизистой оболочки верхних дыхательных путей, часто в виде «слепков» с трахеи и бронхов; продолжительность — 2 — 4 нед.
Иммунитет. После перенесенного заболевания формируется стойкий пожизненный иммунитет; поствакцинальный иммунитет сохраняется всего 3 — 5 лет.
Лабораторная диагностика. Основными методами диагностики являются бактериологический и серологический; для ускоренной диагностики, особенно на ранней стадии болезни, может быть использована реакция иммунофлуоресценции. Для выделения чистой культуры в качестве материала используют слизь из носоглотки или мокроту, которые высевают на КУА или среду Борде — Жангу. Посев также может быть сделан методом «кашлевых пластинок». Выросшую культуру идентифицируют по совокупности культуральных, биохимических и антигенных свойств. Серологические реакции — агглютинации, связывания комплемента, пассивной гемагглютинации — ставятся в основном для ретроспективной диагностики коклюша или в тех случаях, когда не выделена чистая культура. Антитела к возбудителю появляются не ранее 3-й нед. заболевания, диагноз подтверждается возрастанием титра антител в сыворотках, взятых с 1 — 2-недельным интервалом. У детей первых двух лет жизни серологические реакции часто бывают отрицательными.
Специфическая профилактика и лечение. Для плановой профилактики коклюша у детей используют адсорбированную коклюшно-дифтерийно-столбнячную вакцину (АКДС), содержащую 20 млрд убитых коклюшных бактерий в 1 мл. На этом же компоненте основана выпускаемая отдельно убитая коклюшная вакцина, применяемая в детских коллективах по эпидемиологическим показаниям. Этот компонент реактогенен (нейротоксическое свойство), поэтому сейчас активно изучаются бесклеточные вакцины, содержащие от 2 до 5 компонентов (коклюшный анатоксин, филаментозный гемагглютинин, пертактин и 2 агглютиногена фимбрий). Для лечения применяют антибиотики (гентамицин, ампициллин), эффективные в катаральном и бесполезные в судорожном периоде заболевания.
Источник