Шприц для прививки от кори
Содержание статьи
Вакцина коревая культуральная живая (Vaccinum morbillorum culturarum vivum siccum)
Лекарственная форма:  лиофилизат для приготовления раствора для подкожного введения Состав:
Одна прививочная доза препарата содержит:
Действующее вещество:
— вирус кори — не менее 1 000 (3,0 lg) тканевых цитопатогенных доз (ТЦД50).
Вспомогательные вещества:
— стабилизатор — смесь 0,04 мл водного раствора ЛС-18* и 0,01 мл 10 % раствора желатина;
— гентамицина сульфат** — не более 0,5 мкг.
Примечание
*Состав водного раствора ЛС-18: сахароза — 250 мг, лактоза — 50 мг, натрий глутаминовокислый 37,5 мг, глицин — 25 мг, L-пролин — 25 мг, Хенкса сухая смесь с феноловым красным — 7,15 мг, вода для инъекций до 1 мл.
**Технологическая примесь.
Описание:
Лиофилизат — однородная, пористая масса светло-розового цвета, гигроскопична.
Восстановленный препарат — прозрачная жидкость розового цвета.
Характеристика препарата:Вакцина коревая культуральная живая, лиофилизат для приготовления раствора для подкожного введения, готовится методом культивирования вакцинного штамма вируса кори Ленинград-16 (Л-16) на первичной культуре клеток эмбрионов перепелов. Фармакотерапевтическая группа:МИБП — вакцина АТХ:  
J.07.B.D.01 Вирус кори — живой ослабленный
J.07.B.D Вакцина для профилактики кори
Фармакодинамика:
Нет сведений.
Иммунологические свойства:Вакцина стимулирует выработку антител к вирусу кори, которые достигают максимального уровня через 3-4 нед после вакцинации не менее чем у 95% привитых. Препарат соответствует требованиям ВОЗ. Показания:
Плановая и экстренная профилактика кори.
Плановые прививки проводят двукратно в возрасте 12 мес и 6 лет детям, не болевшим корью.
Детей, родившихся от серонегативных к вирусу кори матерей, вакцинируют в возрасте 8 мес и далее — в 14-15 мес и 6 лет. Интервал между вакцинацией и повторной прививкой должен быть не менее 6 мес.
Дети в возрасте от 1 года до 18 лет включительно и взрослые в возрасте до 35 лет включительно, не привитые ранее, не имеющие сведений о прививках против кори, не болевшие корью ранее; взрослые от 36 до 55 лет включительно, относящиеся к группам риска (работники медицинских и образовательных организаций, организаций торговли, транспорта, коммунальной и социальной сферы; лица, работающие вахтовым методом, и сотрудники государственных контрольных органов в пунктах пропуска через государственную границу Российской Федерации), не привитые ранее, не имеющие сведений о прививках против кори, не болевшие корью ранее вакцинируются в соответствии с инструкцией по применению двукратно с интервалом не менее 3-х месяцев между прививками. Лица, привитые ранее однократно, подлежат проведению однократной иммунизации с интервалом не менее 3-х месяцев между прививками.
Экстренную профилактику проводят контактным лицам без ограничения возраста из очагов заболевания, ранее не болевшим, не привитым и не имеющим сведений о профилактических прививках против кори или однократно привитым. При отсутствии противопоказаний вакцину вводят не позднее, чем через 72 ч после контакта с больным.
Противопоказания:
1.Тяжелые формы аллергических реакций на аминогликозиды (гентамицина сульфат и др.), куриные и/или перепелиные яйца.
2.Первичные иммунодефицитные состояния, злокачественные болезни крови и новообразования.
3.Сильная реакция (подъем температуры выше 40 °С, отек, гиперемия более 8 см в диаметре в месте введения) или осложнение на предыдущее введение коревой или паротитно-коревой вакцин.
4.Беременность.
Примечание
При наличии ВИЧ-инфекции допускается вакцинация лиц с 1 и 2 иммунными категориями (отсутствие или умеренный иммунодефицит).
С осторожностью:
Меры предосторожности при применении
Учитывая возможность развития аллергических реакций немедленного типа (анафилактический шок, отек Квинке, крапивница) у особо чувствительных лиц, за привитыми необходимо обеспечить медицинское наблюдение в течение 30 мин.
Места проведения прививок должны быть обеспечены средствами противошоковой терапии.
Беременность и лактация:
Применение при беременности противопоказано.
Допускается проведение вакцинации женщин в период грудного вскармливания по решению врача с учетом оценки соотношения возможного риска заражения и пользы от вакцинации.
Способ применения и дозы:
Непосредственно перед использованием вакцину разводят растворителем (вода для инъекций) из расчета 0,5 мл растворителя на одну прививочную дозу вакцины.
Вакцина должна полностью раствориться в течение 3 мин с образованием прозрачного раствора розового цвета. Не пригодны к применению вакцина и растворитель в ампулах с нарушенной целостностью, маркировкой, а также при изменении их физических свойств (цвета, прозрачности и др.), с истекшим сроком годности, неправильно хранившиеся.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Ампулы в месте надреза обрабатывают 70% спиртом и обламывают, не допуская при этом попадания спирта в ампулу.
Для разведения вакцины стерильным шприцем отбирают весь необходимый объем растворителя и переносят его в ампулу с сухой вакциной. После перемешивания меняют иглу, набирают вакцину в стерильный шприц и делают инъекцию.
Вакцину вводят подкожно в объеме 0,5 мл под лопатку или в область плеча (на границе между нижней и средней третью плеча с наружной стороны), предварительно обработав кожу в месте введения вакцины 70 % спиртом.
Растворенная вакцина используется немедленно и хранению не подлежит.
Проведенную вакцинацию регистрируют в установленных учетных формах с указанием наименования препарата, даты вакцинации, дозы, предприятия-изготовителя, номера серии, даты изготовления, срока годности, реакции на прививку.
Побочные эффекты:
У большинства привитых вакцинальный процесс протекает бессимптомно. После введения вакцины могут наблюдаться следующие реакции различной степени выраженности:
Часто (1/10 — 1/100):
-с 6 по 18 сут могут наблюдаться температурные реакции, легкая гиперемия зева, ринит.
При массовом применении вакцины повышение температуры тела выше 38,5 °С не должно быть более чем у 2% привитых.
Редко (1/1000- 1/10000):
-покашливание и конъюнктивит, продолжающиеся в течение 1-3 сут;
-незначительная гиперемия кожи и слабо выраженный отек, которые проходят через 1-3 сут без лечения.
Очень редко (<1/10000):
-легкое недомогание и кореподобная сыпь;
-судорожные реакции, возникающие чаще всего спустя 6-10 сут после прививки, обычно на фоне высокой температуры;
-аллергические реакции, возникающие в первые 24-48 ч у детей с аллергически измененной реактивностью.
Примечание
Фебрильные судороги в анамнезе, а также повышение температуры выше 38,5 °С в поствакцинальном периоде, являются показанием к назначению антипиретиков.
Передозировка:
Случаи передозировки не установлены.
Взаимодействие:
Вакцинация против кори может быть проведена одновременно (в один день) с другими прививками Национального календаря профилактических прививок (против эпидемического паротита, краснухи, полиомиелита, гепатита В, коклюша, дифтерии, столбняка, гриппа) или не ранее, чем через 1 мес после предшествующей прививки.
После введения препаратов иммуноглобулина человека прививки против кори проводят не ранее, чем через 3 мес. После введения коревой вакцины препараты иммуноглобулина можно вводить не ранее, чем через 2 нед; в случае необходимости применения иммуноглобулина ранее этого срока вакцинацию против кори следует повторить.
После проведения иммуносупрессивной терапии вакцинацию против кори можно проводить через 3-6 мес после окончания лечения.
Особые указания:
Вакцинацию проводят:
— после острых инфекционных и неинфекционных заболеваний, при обострении хронических заболеваний — по окончании острых проявлений заболевания;
— при нетяжелых формах ОРВИ, острых кишечных заболеваниях и др. — сразу после нормализации температуры.
Лица, временно освобожденные от прививок, должны быть взяты под наблюдение и привиты после снятия противопоказаний.
С целью выявления противопоказаний врач (фельдшер) в день вакцинации проводит опрос и осмотр прививаемого с обязательной термометрией.
Влияние на способность управлять трансп. ср. и мех.:
Не установлены.
Форма выпуска/дозировка:Лиофилизат для приготовления раствора для подкожного введения, 0,5 мл/доза. Упаковка:
По 1 или 2 дозы в ампуле.
В пачке 10 ампул с инструкцией по применению и вкладышем с номером укладчика.
Условия хранения:
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С.
Хранить в недоступном для детей месте.
Условия транспортирования:В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С. Срок годности:
2 года.
Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска из аптек:Для стационаров Регистрационный номер:ЛС-002140 Дата регистрации:21.02.2011 / 29.06.2020 Дата окончания действия:Бессрочный Владелец Регистрационного удостоверения:МИКРОГЕН НПО, АОМИКРОГЕН НПО, АО Россия Производитель:   Дата обновления информации:  20.03.2021 Иллюстрированные инструкции Инструкции
Источник
Вакцина коревая культуральная живая лиофилизат 0.5 — Микроген — инструкция по применению
Синонимы, аналоги Статьи
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Вакцина коревая культуральная живая
Торговое наименование препарата
Вакцина коревая культуральная живая
Лекарственная форма
лиофилизат для приготовления раствора для подкожного введения
Состав
Одна прививочная доза препарата (0,5 мл) содержит:
Действующее вещество:
— вирус кори — не менее 1 000 (3,0 lg) тканевых цитопатогенных доз (ТЦД50).
Вспомогательные вещества:
— стабилизатор — смесь 0,04 мл водного раствора ЛС-18* и 0,01 мл 10% раствора желатина;
— гентамицина сульфат — не более 10 мкг.
Примечание
*Состав водного раствора ЛС-18: сахароза 250 мг, лактоза 50 мг, натрий глутаминовокислый 37,5 мг, глицин 25 мг, L-пролин 25 мг, Хенкса сухая смесь с феноловым красным 7,15 мг, вода для инъекций до 1 мл.
Описание
Лиофилизат — однородная, пористая масса светло-розового цвета, гигроскопична.
Восстановленный препарат- прозрачная жидкость розового цвета.
Фармакотерапевтическая группа
МИБП-вакцина
Фармакодинамика:
Вакцина коревая культуральная живая лиофилизат для приготовления раствора для подкожного введения готовится методом культивирования вакцинного штамма вируса кори Ленинград-16 (Л-16) на первичной культуре клеток эмбрионов перепелов.
Иммунологические свойства. Вакцина стимулирует выработку антител к вирусу кори которые достигают максимального уровня через 3-4 нед после вакцинации не менее чем у 95% привитых. Препарат соответствует требованиям ВОЗ.
Показания:
Плановая и экстренная профилактика кори.
Плановые прививки проводят двукратно в возрасте 12 мес и 6 лет детям не болевшим корью.
Детей родившихся от серонегативных к вирусу кори матерей вакцинируют в возрасте 8 мес и далее — в 14-15 мес и 6 лет. Интервал между вакцинацией и повторной прививкой должен быть не менее 6 мес.
Дети в возрасте от 1 года до 18 лет включительно и взрослые в возрасте до 35 лет (включительно) не привитые ранее не имеющие сведений о прививках против кори не болевшие корью ранее вакцинируются в соответствии с инструкцией по применению двукратно с интервалом не менее 3-х месяцев между прививками. Лица привитые ранее однократно подлежат проведению однократной иммунизации с интервалом не менее 3-х месяцев между прививками.
Экстренную профилактику проводят контактным лицам без ограничения возраста из очагов заболевания ранее не болевшим не привитым и не имеющим сведений о профилактических прививках против кори или однократно привитым. При отсутствии противопоказаний вакцину вводят не позднее чем через 72 ч после контакта с больным.
Противопоказания:
1. Тяжелые формы аллергических реакций на аминогликозиды (гентамицина сульфат и др.) куриные и/или перепелиные яйца.
2. Первичные иммунодефицитные состояния злокачественные болезни крови и новообразования.
3. Сильная реакция (подъем температуры выше 40 °С отек гиперемия более 8 см в диаметре в месте введения) или осложнение на предыдущее введение коревой или паротитно-коревой вакцин.
4. Беременность.
Примечание
При наличии ВИЧ-инфекции допускается вакцинация лиц с 1 и 2 иммунными категориями (отсутствие или умеренный иммунодефицит).
Беременность и лактация:
Применение при беременности противопоказано.
Допускается проведение вакцинации женщин в период грудного вскармливания по решению врача с учетом оценки соотношения возможного риска заражения и пользы от вакцинации.
Способ применения и дозы:
Непосредственно перед использованием вакцину разводят растворителем для коревой паротитной и паротитно-коревой вакцин культуральных живых (далее именуется растворитель) из расчета 05 мл растворителя на одну прививочную дозу вакцины.
Вакцина должна полностью раствориться в течение 3 мин с образованием прозрачного раствора розового цвета. Не пригодны к применению вакцина и растворитель в ампулах с нарушенной целостностью маркировкой а также при изменении их физических свойств (цвета прозрачности и др.) с истекшим сроком годности неправильно хранившиеся.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Ампулы в месте надреза обрабатывают 70% спиртом и обламывают не допуская при этом попадания спирта в ампулу.
Для разведения вакцины стерильным шприцем отбирают весь необходимый объем растворителя и переносят его в ампулу с сухой вакциной. После перемешивания меняют иглу набирают вакцину в стерильный шприц и делают инъекцию.
Вакцину вводят подкожно в объеме 05 мл под лопатку или в область плеча (на границе между нижней и средней третью плеча с наружной стороны) предварительно обработав кожу в месте введения вакцины 70% спиртом.
Растворенная вакцина используется немедленно и хранению не подлежит.
Проведенную вакцинацию регистрируют в установленных учетных формах с указанием наименования препарата даты вакцинации дозы предприятия-изготовителя номера серии даты изготовления срока годности реакции на прививку.
Меры предосторожности при применении
Учитывая возможность развития аллергических реакций немедленного типа (анафилактический шок отек Квинке крапивница) у особо чувствительных лиц за привитыми необходимо обеспечить медицинское наблюдение в течение 30 мин.
Места проведения прививок должны быть обеспечены средствами противошоковой терапии.
Побочные эффекты:
У большинства привитых вакцинальный процесс протекает бессимптомно. После введения вакцины могут наблюдаться следующие реакции различной степени выраженности:
Часто (1/10 — 1/100):
— с 6 по 18 сут могут наблюдаться температурные реакции легкая гиперемия зева ринит.
При массовом применении вакцины повышение температуры тела выше 385 °С не должно быть более чем у 2% привитых.
Редко (1/1000- 1/10000):
— покашливание и конъюнктивит продолжающиеся в течение 1-3 сут;
— незначительная гиперемия кожи и слабо выраженный отек которые проходят через 1-3 сут без лечения.
Очень редко (<1/10000):
— легкое недомогание и кореподобная сыпь;
— судорожные реакции возникающие чаще всего спустя 6-10 сут после прививки обычно на фоне высокой температуры;
— аллергические реакции возникающие в первые 24-48 ч у детей с аллергически измененной реактивностью.
Примечание
Фебрильные судороги в анамнезе а также повышение температуры выше 385 °С в поствакцинальном периоде являются показанием к назначению антипиретиков.
Передозировка:
Случаи передозировки не установлены.
Взаимодействие:
Вакцинация против кори может быть проведена одновременно (в один день) с другими прививками Национального календаря профилактических прививок (против эпидемического паротита краснухи полиомиелита гепатита В коклюша дифтерии столбняка) или не ранее чем через 1 мес после предшествующей прививки.
После введения препаратов иммуноглобулина человека прививки против кори проводят не ранее чем через 3 мес. После введения коревой вакцины препараты иммуноглобулина можно вводить не ранее чем через 2 нед; в случае необходимости применения иммуноглобулина ранее этого срока вакцинацию против кори следует повторить.
После проведения иммуносупрессивной терапии вакцинацию против кори можно проводить через 3-6 мес после окончания лечения.
Особые указания:
Вакцинацию проводят:
— после острых инфекционных и неинфекционных заболеваний при обострении хронических заболеваний — по окончании острых проявлений заболевания;
— при нетяжелых формах ОРВИ острых кишечных заболеваниях и др. — сразу после нормализации температуры.
Лица временно освобожденные от прививок должны быть взяты под наблюдение и привиты после снятия противопоказаний.
С целью выявления противопоказаний врач (фельдшер) в день вакцинации проводит опрос и осмотр прививаемого с обязательной термометрией.
Влияние на способность управлять трансп. ср. и мех.:
Не установлены.
Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для подкожного введения 05 мл/доза.
Упаковка:
По 1 или 2 дозы в ампуле.
В пачке 10 ампул с инструкцией по применению и вкладышем с номером укладчика.
Условия хранения:
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С. Хранить в недоступном для детей месте.
Условия транспортирования
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С.
Срок годности:
2 года.
Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
По рецепту
Производитель
Акционерное общество «Научно-производственное объединение по медицинским иммунобиологическим препаратам «Микроген» (АО «НПО «Микроген»), 115088, г. Москва, ул. Дубровская 1-я, двлд. 15, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
АО «НПО «Микроген»
Вакцина коревая культуральная живая лиофилизат 0.5 — Микроген — цена, наличие в аптеках
Указана цена, по которой можно купить Вакцина коревая культуральная живая лиофилизат 0.5 — Микроген в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Преимущества предварительно заполненных шприцев в ходе инициатив по вакцинопрофилактике
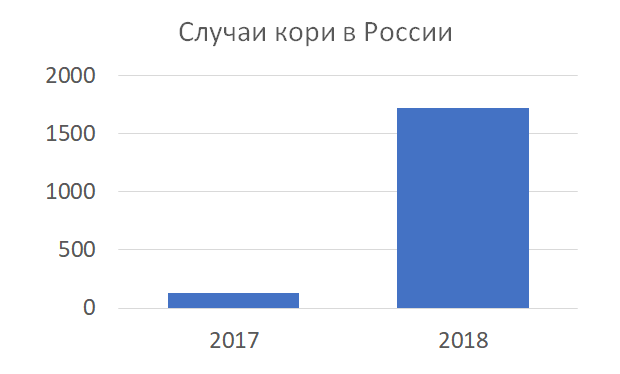
Частота случаев кори в России за шесть месяцев 2018 г. по сравнению с аналогичным периодом в 2017 г. выросла в 13,5 раз — было зарегистрировано 127 и 1717 случаев, соответственно. (График 1. (Vedyashkin, 2018))
График 1. Частота случаев кори в России выросла в 13,5 раз с 2017 г. по 2018 г. (127 и 1717 случаев, соответственно).
Подобный рост заболеваемости корью на территории Российской Федерации и в близлежащих странах вынудили главного государственного санитарного врача Российской Федерации издать постановление, предписывающее всеобщий охват вакцинацией непривитых лиц в данном регионе. (Grigoryan, 2019) Вероятно, что повышение заболеваемости предотвратимыми вирусными заболеваниями, такими как корь, будет закономерно приводить к росту вакцинации. (Kolosova, 2019)
Хотя кампании по вакцинации могут быть дорогостоящими, соответствующие организации могут снижать затраты в долгосрочной перспективе за счет выбора эффективных систем доставки. Несмотря на более низкую себестоимость при упаковке во флаконы, использование вакцин в готовых к применению предварительно заполненных шприцах потенциально уменьшает сложность и стоимость процедуры вакцинации, а также время, необходимое для реализации программы вакцинации.
Использование предварительно заполненных шприцев может также помочь в борьбе с социальным беспокойством, связанным с прививками, благодаря отсутствию консервантов в составе вакцины. Далее следуют рассуждения об экономии времени и денег в случае изначальной поставки вакцин в готовых к применению предварительно заполненных шприцах вместо одноразовых или многоразовых (многодозовых) флаконов.
Использование предварительно заполненных шприцев снижает трудозатраты и долю выброшенных единиц вакцины
При проведении кампаний по вакцинации следует сфокусироваться на максимальном сокращении расходов. Правильный способ доставки препарата может снизить общие затраты благодаря оптимизации трудозатрат и доли выброшенных единиц вакцины. (Pereira, 2010)
Трудозатраты
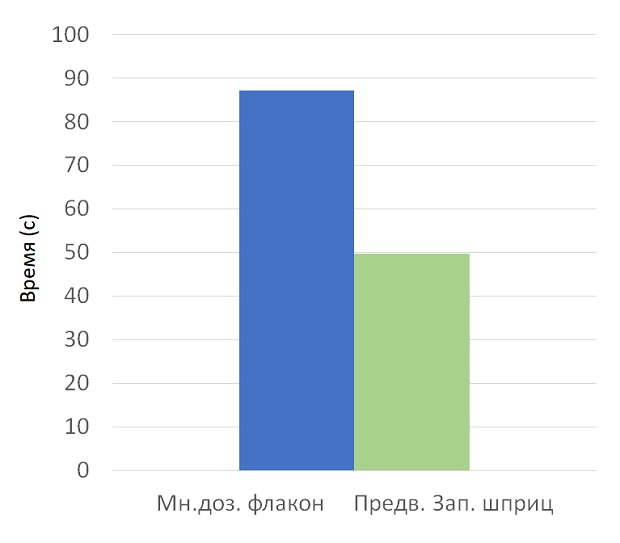
Было показано, что упаковка препарата в предварительно заполненных шприцах значительно снижает время на его приготовление к введению и само введение. (Adapa, 2012) В действительности, исследования показывают, что более высокая себестоимость упаковки вакцин в предварительно заполненных шприцах может частично компенсироваться таким преимуществом, как экономия времени. (График 2. (Pereira, 2010))
График 2. Приготовление вакцины из многодозового флакона заняло на ~ 37,3 с больше, чем при использовании предварительно заполненных шприцев (87 с в сравнении с 49,7 с).
Например, если в рамках соответствующей национальной кампании вакцинации подлежат 100 тыс. человек и каждый медицинский работник будет использовать предварительно заполненные шприцы вместо флаконов/ампул, трудозатраты можно сократить более чем на 1 036 часов. Вероятно, при подобном подходе также можно вакцинировать больше человек за день, что потенциально сократит продолжительность кампании по вакцинации.
Количество выброшенных единиц вакцины
По оценкам Всемирной организации здравоохранения (ВОЗ), до 50% единиц вакцины, приобретаемых для кампаний по вакцинации во всем мире, выбрасывается по разным причинам. (World Health Organization, 2005) Недавно проведенные исследования в развивающихся странах позволили сделать вывод, что 8-27% подобных случаев обусловлены закупкой многодозовых флаконов: их утилизируют в связи с риском остатка неиспользованных доз вакцины или истекшим сроком годности оставшихся доз. (Patel, 2016) (Tiwari, 2017) (Yang, 2014) (Parmar, 2010) Иногда во время кампаний по вакцинации медицинские работники предварительно набирают в шприцы несколько доз из флаконов, чтобы подготовиться к пациентам, поступающим позже в тот же день. (Pereira, 2010)
Дозы, набранные в шприц из флакона, считаются стерильными только в течение 12 часов, в то время как срок годности предварительно заполненных шприцев составляет 2-3 года. (Makwana, 2011) То есть, неиспользованные дозы, набранные в шприц из флакона, нельзя использовать уже на следующий день, а неиспользованные предварительно заполненные шприцы, при условии соблюдения холодовой цепи, можно вернуть на склад и использовать до истечения срока годности, напечатанного на упаковке.
Другой аспект распределения затрат для клиентов и поставщиков заключается в необходимости изначально создавать избыток вакцины во флаконе на этапе производства. Это обусловлено тем, что шприцем невозможно извлечь 100% дозы из флакона, поэтому для компенсации создается избыток объема во флаконе 20-25%. Необходимый избыток объема при расфасовке вакцины в предварительно заполненные шприцы значительно меньше. (Makwana, 2011)
Стоимость избыточного объема покрывается либо фармацевтической компанией, либо отражается на стоимости для покупателя. В целях борьбы с основными проблемами, связанными с выбросом определенного количества вакцины, ВОЗ и ЮНИСЕФ предлагают использовать вакцины в наименьшей дозе, например, флакон с однократной дозой или предварительно заполненные шприцы. (UNICEF, 2010) (World Health Organization, 2005)
При этом сравнение однодозовых флаконов и предварительно заполненных шприцев позволяет сделать вывод, что предварительно заполненные шприцы обеспечивают более быстрое введение, а также не требуют места для хранения и использования дополнительных шприцев и игл. Это позволит клиникам и организациям, специализирующимся на проведении вакцинации, более эффективно использовать дозы вакцин, сократить потенциальное время ожидания пациентов, увеличить ежедневный пациентопоток, сократить количество выброшенных единиц вакцины и сэкономить на общей стоимости проведения вакцинации.
Тем не менее, следует просчитать расходы, связанные с необходимостью соблюдения холодовой цепи. Некоторыми исследователями был сделан вывод, что переход от больших многодозовых флаконов к более мелким видам упаковки увеличивает расходы, связанные с хранением в холоде. (Yang, 2014) (Parmar, 2010) Понимание финансовых расходов, связанных с увеличением хранения в холодной цепи, и таких факторов, как цепочка поставок вакцин, размер кампании по иммунизации и цели проекта, должно учитываться при оценке общей экономии затрат, связанных с меньшим количеством выброса препарата из однодозовых контейнеров. (Haidari, 2015)
Нарушение безопасности техники введения
Медицинские работники должны убедиться в соблюдении строгих рекомендаций в отношении хранения, срока годности извлеченной вакцины и дезинфекции поверхности перед извлечением дозы из флакона. Однако из-за более продолжительного времени приготовления вакцины к введению и потенциальной возможности образования доз, подлежащих выбрасыванию, использование многодозовых флаконов влечет за собой возможные нарушения требований безопасности к процедурам клинической практики. (Pereira, 2010)
Pereira и соавт. описывают следующие наблюдения: во время кампании по вакцинации медицинские сестры повторно использовали спиртовые тампоны, заранее набирали целую серию доз в шприцы или же набирали остатки вакцины из нескольких флаконов до объема полной дозы. Повторное использование спиртовых тампонов при обработке одного и того же или разных флаконов приводит к снижению эффективности обработки для уменьшения бактериальной или вирусной контаминации поверхностей. (vanVlymen, 2019)
Заблаговременный набор нескольких доз вакцины может привести к неправильному прогнозированию количества необходимых доз (оставшиеся неиспользованные дозы будут выброшены), а также к неправильной регистрации номеров партии вакцины. (Pereira, 2010) Набор дозы в один шприц из нескольких уже вскрытых флаконов может увеличить вероятность микробного заражения. (Pereira, 2010) (vanVlymen, 2019)
В связи с этим многие правительственные органы, в том числе Центр контроля и профилактики заболеваний США (Center for Disease Control — CDC), рекомендуют при любой возможности использовать однодозовые варианты упаковки. (Joint Commission, 2014) Применение подобных процедур клинической практики, нарушающих требования безопасности, можно предотвратить путем использования предварительно заполненных шприцев вместо многодозовых флаконов.
Общественное мнение по поводу консервантов в вакцинах, упакованных в многодозовые флаконы
Для упаковки вакцин также используются многодозовые флаконы, при этом в состав добавляется бактериостатическое вещество в целях продления срока годности вакцины после вскрытия флакона. (Spencer, 2017) В средствах массовой информации была распространена ошибочная информация о том, что один из подобных ингредиентов в многодозовых флаконах противогриппозной вакцины, тимеросал, приводит к развитию серьезных побочных эффектов, несмотря на научные доказательства его безопасности. (Spencer, 2017) (DeStefano, 2019)
В России дезинформация часто встречается в социальных сетях и периодически распространяется известными певцами или актерами. (Gershkovich, 2018) Подобная дезинформация приводит к тому, что родители отказываются вакцинировать детей. (Pandolfi, 2018) (Gershkovich, 2018) В результате медицинские эксперты обеспокоены растущим риском того, что коллективный поствакцинальный иммунитет не достигнет необходимой отметки — примерно 52 % для сезонного гриппа и 92-95% для таких распространенных заболеваний, как дифтерия и корь. (Gershkovich, 2018) (Kolosova, 2019)
Эти опасения являются оправданными, т.к. территория вспышек кори уже расширяется. (Vedyashkin, 2018) Одним из преимуществ вакцин в предварительно заполненных шприцах является то, что при таком варианте упаковки не требуются консерванты, которые используются в многодозовых флаконах. Хотя опасность консервантов в значительной степени преувеличена в связи с дезинформацией, полное их исключение из состава вакцины может успокоить сомневающиеся слои населения и увеличить их приверженность к вакцинации.
Предварительно заполненные шприцы — одно решение для нескольких проблем
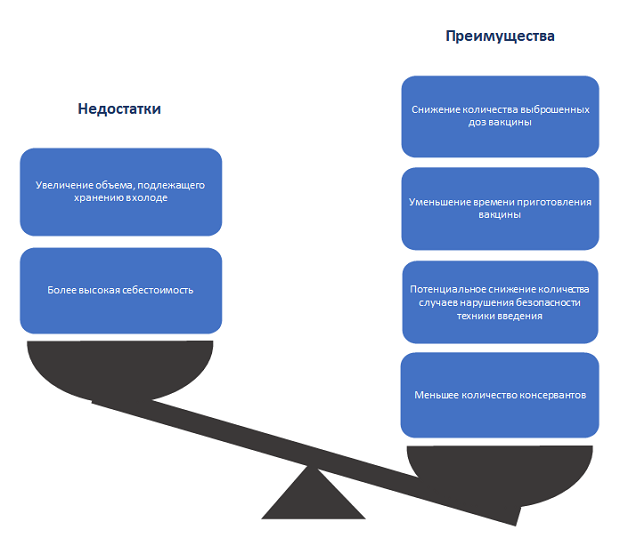
Выбор правильной первичной упаковки для вакцины — важное решение, которое может напрямую повлиять на долгосрочные затраты. (График 3) Когда организации, занимающиеся вакцинацией, стремятся сократить расходы, они направляют усилия на снижение неэффективности рабочего процесса и доли выброшенных единиц вакцины.
График 3. Сравнение преимуществ и недостатков предварительно заполненных шприцев.
Система здравоохранения продолжает уделять больше внимания безопасности, следуя цели снизить частоту нарушений безопасности техники введения вакцины. Если уровень заболеваемости предотвратимыми заболеваниями продолжит расти, государственные органы будут искать способы борьбы с социальным психологическим давлением, которое приводит к отклонению от рекомендуемых календарей вакцинации.
Несмотря на то, что упаковка вакцины в предварительно заполненных шприцах изначально может стоить дороже, чем во флаконах, предварительно заполненные шприцы показали способность решить все перечисленные проблемы при снижении потенциальной чистой себестоимости по сравнению с однодозовыми или многодозовыми флаконами.
О компании BD
BD — это ведущая международная компания, которая разрабатывает, производит и продает медицинское оборудование, изделия медицинского назначения, приборы и реагенты. Деятельность компании направлена на улучшение здоровья людей по всему миру. Основными направлениями работы компании BD являются улучшение систем доставки лекарственных средств, совершенствование диагностики инфекционных заболеваний и рака, а также поддержка разработки новых лекарственных средств. Компания BD предлагает передовые технические решения для игл, предварительно заполняемые шприцы, системы безопасности и защиты, а также системы для самостоятельного введения препарата для фармацевтических и биотехнологических компаний по всему миру.
Благодаря экспертизе в вопросах взаимодействия лекарственных средств с упаковкой, подбора первичной упаковки и интеграции флаконов и устройств для проведения лекарственной терапии компания BD обладает уникальными возможностями по созданию предварительно заполняемых шприцевых систем.
Так как вакцины являются чувствительными продуктами, они производятся в стерильных условиях и находятся под контролем критической температуры до момента их использования. Данные профилактические препараты обычно назначаются младенцам, маленьким детям и пожилым людям. По этим причинам очень важно выбрать правильную систему введения вакцины — специализированные шприцы BD для вакцин Hypak™ for Vaccines.
Использование специализированных шприцев BD для вакцин способствует глобальным усилиям по вакцинации, обеспечивая более качественную клиническую помощь, повышая экономическую ценность и содействуя вакцинации большего числа людей.
BD Hypak™ for Vaccines соответствует строго контролируемым спецификациям клиентов, адаптированным к текущим потребностям производства вакцин.
Более 74% из 100 ведущих фармацевтических компаний мира используют системы доставки лекарств предварительного наполнения от BD Medical-Pharmaceutical Systems для широкого спектра терапевтических применений (в рамках анализа препаратов исключительно в шприцах предварительного наполнения).
Ресурсы компании BD служат орудием в борьбе с наиболее серьезными заболеваниями человечества. Головной офис компании, основанной в 1897 г., находится в США, штат Нью Джерси, Франклин Лэйкс. Общая численность сотрудников составляет почти 30 тыс. человек в более чем 50 странах мира. Компания сотрудничает с учреждениями здравоохранения, научно-исследовательскими лабораториями, взаимодействует с представителями фармацевтической индустрии, поддерживает проведение научных исследований, а также осуществляет свободные продажи населению.
Список литературы
Adapa, R. (2012). Errors during the preparation of drug infusions: a randomized controlled trial. Br J Anesth, 729-734.
Atcheson, C. e. (2016). Preventable drug waste among anesthesia providers: opportunities for efficiency. J Clin Anesth, 24-32.
Bellefleur, J. (2009). Use of ephedrine prefilled syringes reduces anesthesia costs. Annales francaises d’anesthesie et de reanimation, 211-214.
Benhamou, D. (2017). Ready-to-use pre-filled syringes of atropine for anaesthesia care in French hospitals — a budget impact analysis. Anaesthesia Critical Care & Pain Medicine, 115-121.
DeStefano, F. (2019). The MMR Vaccine and Autism. Annual Review of Virology, 1-16.
Gargiulo, D. e. (2016). Microbiological Contamination of Drugs during Their Administration for Anesthesia in the Operating Room. Anesthesiology, 785-794.
Gavi 2. (2016). Immunization — A healthy return on investment. Retrieved from Gavi — the vaccine alliance: https://www.gavi.org/library/audio-visual/graphics/immunisation—a-healthy-return-on-investment/
Gavi. (2016). Value of vaccination. Retrieved from Gavi — the vaccine aliance: https://www.gavi.org//value/
Gershkovich, E. (2018, September 28). Russia has a vaccination problem. The Moscow s, pp. https://www.themoscows.com/2018/09/28/russia-has-a-vaccine-problem-a63017.
Grigoryan, A. (2019, May 9). Russia: Government Expanding Vaccination for Measles Amid Outbreak in Neighboring Countries. Retrieved from US Library of Congress: https://www.loc.gov/law/foreign-news/article/russia-government-expanding-vaccination-for-measles-amid-outbreak-in-neighboring-countries/
Guadagnino, E., & Zuccato, D. (2012). Delamination propensity of pharmaceutical glass containers by accelerated testing with different ction . PDA J PharmSciTech, 116-125.
Haidari, L. (2015). One size does not fit all: The impact of promary vaccine container size on vaccine distribution and delivery. Vaccine, 3242-3247.
HHS, U. D. (2019). Medication Errors and Adverse Drug Events.
Jenke, D. (2014). ctables and leachables considerations for prefilled syringes. Expert Opin Drug Delivery, 1591-1600.
Jennings, B. e. (2011). The nurse’s medication day. Qual Health Res, 1441-1451.
Joint Commission. (2014). Preventing infection from the misuse of vials. Sentinel Event Alert, Issue 52, 1-6.
Kolosova, N. (2019). Severe cases of seasonal influenza in Russia in 2017-2018. PLoS One, 1-16.
Kossover-Smith, R. (2017). One needle, one syringe, only one ? A survey of physician and nurse knowledge, attitudes, and practices around injection safety. AJIC, 1018-1023.
Lahue, B. e. (2012). National Burden of Preventable Adverse Drug Events Associated with Inpatient Injectable Medications: Healthcare and Medical Professional Liability Costs. Amer Health & Drug Benefits, 413-422.
Larmené- Beld, K. (2018). Kant en klare steriliseerbare spuiten. Symposium NVKFAZ. Isala.
Makwana, S. (2011). Prefilled syringes: An innovation in parenteral packaging. Int J Pharm INvestig, 200-206.
Moreira, M. (2015). Color-Coded Prefilled Medication Syringes Decrease to Delivery and Dosing Error in Simulated Emergency Department Pediatric Resuscitations. Ann Emerg Med, 97-106.
Pandolfi, F. (2018). The importance of Complying with Vaccination Protocols in Developed Countries: «Anti-Vax» Hysteria and the Spread of Severe Preventable Diseases. Curr Med Chem, 6070-6081.
Parmar, D. (2010). Impact of wastage on sinfle and multi-dose vaccines vials. Implications for ducing pneumococcal vaccines in developing countries. Hum Vaccin, 270-278.
Patel, P. (2016). Vaccine Wastage Assessment After duction of Open. Vaccine Wastage Assessment After duction of Open, 233-236.
Pereira, C. C. (2010). Vaccine Presentation in the USA: Economics of Prefilled Syringes versus Multidose Vials for Influenza Vaccination. Expert Review of Vaccines, 1343-1349.
Pugliese, G. (2010). Injection practices among clinicians in United es health care settings. (Am J Infect Control, 789-98.
Spencer, J. (2017). Vaccine Adverse Events. Saparating Myth from Reality. Am Fam Physician, 786-794.
Tian, L. (2014). Health Care-Associated Infection Prevalence Among Grade a Tertiary Hospitals in China: A -Analysis. Value in Health, A861.
Tiwari, R. (2017). A study to assess vaccine wastage in an immunization clinic of tertiary care centre, Gwalior, Madhya Pradesh, India. International Journal of Re in Medical Sciences, 2472-2476.
UNICEF. (2010). Vaccine Wastage Assessment. UNICEF.
vanVlymen, J. (2019). Hepatitis C Contamination of medication vials accessed with sterile needles and syringes. Anesthesiology, 305-314.
Vedyashkin, S. (2018, August 4th). Measles Cases Jump 13-Fold in Russia in 2018. Moscow s, pp. https://www.themoscows.com/2018/08/24/measles-cases-jump-13-fold-russia-2018-a62659.
Vogl, T., Wessling, J., & Buerke, B. (2012). An observational study to evaluate the efficiency and safety of ioversol pre-filled syringes compared with ioversol bottles in contrast-enhanced examinations. Acta Radiologica, 914-920.
Westbrook, J. (2011). Errors in the administration of intravenous medications in hospital and the role of correct procedures and nurse experience. BMJ Qual Saf, 1027-1034.
World Health Organization. (2005). Monitoring vaccine wastage at a country level. Geneva: World Health Organization.
Yang, W. (2014). The Budget impact of controlling wastage with smaller vials: A data driven model of sessions sizes in Bangladesh, India (Uttar Pradesh), Mozambique, and Uganda. Vaccine, 6643-6648.
Zhao, J. e. (2014). Glass delamination: a comparison of the inner surface performance of vials and pre-filled syringes. AAPS Pharm Sci Tech, 1398-1409.
Источник