Морфологические свойства возбудителя коклюша
Содержание статьи
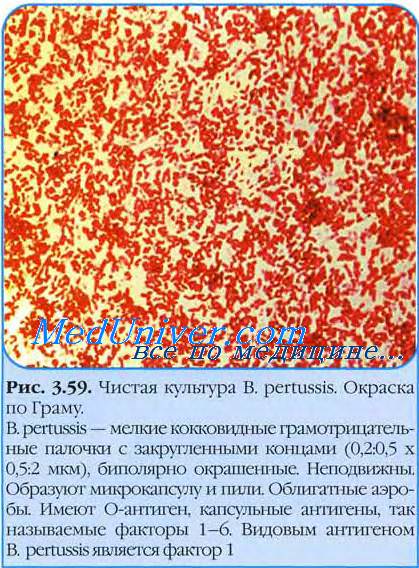
орфология возбудителя коклюша. Тинкториальные свойства возбудителя коклюша. палочка Борде-Жангу. Bordetella pertussis.
Оглавление темы «Франциселлы. Возбудитель туляремии. Бруцеллы. Бруцеллёз. Бордетеллы. Возбудитель коклюша.»:
1. Культуральные свойства франциселл. Культуральные свойства возбудителя туляремии. Биохимические свойства франциселл. Биохимические свойства туляремии.
2. Патогенез поражений франциселл. Патогенез поражений возбудителя туляремии. Туляремийные бубоны.
3. Диагностика туляремии. Принципы микробиологической диагностики возбудителей туляремии. Тулярин. Лечение туляремии и профилактика туляремии.
4. Бруцеллы. Бруцеллёз. Палочка Банга. Свойства бруцелл. Эпидемиология бруцелл. Распространенность бруцелл.
5. Морфология бруцелл. Культуральные свойства бруцелл. Биохимические свойства бруцелл.
6. Антигены бруцелл. Антигенная структура бруцелл. Патогенез поражений бруцеллами. Патогенез бруцеллеза.
7. Клиника бруцеллеза. Клинические проявления бруцеллёза. Признаки бруцеллеза. Симптомы бруцеллёза. Диагностика бруцеллеза. Выявление бруцелл.
8. Лечение бруцеллеза. Профилактика бруцеллеза. Вакцина против бруцеллеза.
9. Бордетеллы. Род Bordetella. Коклюш. Возбудитель коклюша. Эпидемиология коклюша. Распространенность коклюша.
10. Морфология возбудителя коклюша. Тинкториальные свойства возбудителя коклюша. палочка Борде-Жангу. Bordetella pertussis.
Морфология возбудителя коклюша. Тинкториальные свойства возбудителя коклюша. палочка Борде-Жангу. Bordetella pertussis.
Bordetella pertussis — мелкая овоидная палочка, размером 0,2-0,5×1,0-1,2 мкм. Неподвижна, образует капсулу. Клетки возбудителя коклюша плохо окрашиваются по Граму, предпочтительно использовать толуидиновый синий, выявляющий биполярные метахро-матические гранулы (клеточные липоиды).
Коклюшная палочка — строгий аэроб; каталаза-положительна. Углеводы практически не ферментирует, требовательна к питательным средам. Кроме того, росту возбудителя коклюша препятствуют накапливающиеся в среде жирные кислоты, ингибирующие их рост. Поэтому в культуральные среды вносят адсорбенты — активированный уголь, крахмал, альбумин и др.
Наиболее часто используют агар Борде-Жангу и казеиново-угольный агар (КУА).
• Через 3-5 сут на агаре Борде-Жангу коклюшная палочка образует небольшие (1 мм в диаметре) сероватые, выпуклые и блестящие колонии, напоминающие капельки ртути или жемчужины, окружённые зоной слабого гемолиза.
На КУА колонии возбудителя коклюша блестящие, серовато-кремового цвета. При изменении состава питательной среды или условий культивирования бордетеллы быстро изменяют тип роста и антигенные свойства. Переход от S-формы (I фаза) к R-форме (IV фаза) происходит через промежуточные II и Ш фазы и сопровождается изменением набора Аг и потерей вирулентных свойств.
• В жидких средах (20% кровяной бульон) бактерии дают незначительное помутнение, образуют плёнку (иногда со спускающимися вниз отростками типа сталактитов); к 10-14-м суткам культивирования образуют осадок, среда при этом становится прозрачной.
— Также рекомендуем «Антигены коклюша. Антигенная структура возбудителя коклюша. Фазы бактерий коклюша. Факторы патогенности возбудителя коклюша.»
— Вернуться в оглавление раздела «микробиология»
Источник
№ 20 Возбудители коклюша и паракоклюша. Таксономия и характеристика. Микробио…
№ 20 Возбудители коклюша и паракоклюша. Таксономия и характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Коклюш — острая инфекционная болезнь, характеризующаяся поражением верхних дыхательных путей, приступами спазматического кашля; наблюдается преимущественно у детей. Возбудитель коклюша Bordetellapertussis
Таксономия.B.pertussis относится к отделу Gracilicutes, роду Bordetella.
Морфологические и тинкториальные свойства. В.pertussis — мелкая овоидная грамотрицательная палочка с закругленными концами. Спор и жгутиков не имеет, образует микрокапсулу, пили.
Культуральные и биохимические свойства. Строгий аэроб. Оптимальная температура культивирования 37С. B.pertussis очень медленно растет только на специальных питательных средах, например на среде Борде — Жангу (картофельно-глицериновый агар с добавлением крови), образуя колонии, похожие на капельки ртути.Характерна R-S-трансформация. Расщепляют глк. и лактозу до кислоты без газа.
Антигенная структура. О-антиген термостабильный родоспецифический. 14 поверхностных термолабильных капсульных К-антигенов. В.pertussis имеет 6 сероваров. Фактор 7 является общим для всех бордетелл. Для В.parapertussis специфический фактор 14. К – антигены выявляют в реакции агглютинации.
Факторы патогенности. Термостабильный эндотоксин, вызывающий лихорадку; белковый токсин, обладающий антифагоцитарной активностью и стимулирующий лимфоцитоз; ферменты агрессии, повышающие сосудистую проницаемость, обладающие гистаминсенсибилизирующим действием, адгезивными свойствами и вызывающие гибель эпителиальных клеток. В адгезии бактерий также участвуют гемагглютинин, пили и белки наружной мембраны.
Резистентность. Очень неустойчив во внешней среде, быстро разрушается под действием дезинфектантов и других факторов.
Эпидемиология. Коклюш — антропонозная инфекция: источником заболевания являются больные люди и в очень незначительной степени бактерионосители. Заражение происходит через дыхательный тракт, путь передачи воздушно-капельный. Коклюш встречается повсеместно, очень контагиозен. Паракоклюш реже, эпизодический характер. Протекает легче.
Патогенез. Неинвазивные микробы (не проникают внутрь клетки-мишени). Входными воротами инфекции являются верхние дыхательные пути. Здесь благодаря адгезивным факторам бордетеллы адсорбируются на ресничках эпителия, размножаются, выделяют токсины и ферменты агрессии. Развиваются воспаление, отек слизистой оболочки, при этом часть эпителиальных клеток погибает. В результате постоянного раздражения токсинами рецепторов дыхательных путей появляется кашель. В возникновении приступов кашля имеет значение и сенсибилизация организма к токсинам B.pertussis.
Клиника. Инкубационный период составляет 2—14 дней. В начале болезни появляются недомогание, невысокая температура тела, небольшой кашель, насморк. Позже начинаются приступы спазматического кашля, заканчивающиеся выделением мокроты. Таких приступов может быть 5—50 в сутки. Болезнь продолжается до 2 мес.
Иммунитет. После перенесенной болезни иммунитет стойкий, сохраняется на протяжении всей жизни. Видоспецифический (антитела против В.pertussis не защищают от заболеваний, вызванных В.parapertussis.
Микробиологическая диагностика. Материалом для исследования служит слизь из верхних дыхательных путей, используют метод «кашлевых пластинок» (во время приступа кашля ко рту ребенка подставляют чашку Петри с питательной средой). Основной метод диагностики — бактериологический. Позволяет отдифференцировать возбудителя коклюша от паракоклюша. Посев на плотные питательные среды с антибиотиками. Для идентификации возбудителя – реакция агглютинации на стекле с К-сыворотками. Для ускоренной диагностики применяют прямую РИФ со специфической флуоресцентной сывороткой и материалом из зева. Серологический метод – обнаружение IgG и IgA против феламентозного гемаггютинина и против токсина В.pertussis.
Лечение.Антимикробные препараты – эритромицин, ампициллин (кроме пенициллина). При тяжелых формах коклюша применяют нормальный человеческий иммуноглобулин. Рекомендуются антигистаминные препараты, холодный свежий воздух. При легких формах заболевания достаточно пребывания на воздухе.
Профилактика. Адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС). В ее состав входит убитая культура В. pertussisI фазы, коклюшный токсин, агглютиногены, капсульный антиген. Нормальный человеческий иммуноглобулин вводят неиммунизированным детям при контакте с больными для экстренной профилактики. Разрабатывается неклеточная вакцина с меньшими побочными эффектами, содержащая анатоксин, гемагглютинин, пертактин и антиген микроворсинок.
Паракоклюш вызывает Bordetellaparapertussis. Паракоклюш сходен с коклюшем, но протекает легче. Паракоклюш распространен повсеместно и составляет примерно 15 % от числа заболеваний с диагнозом коклюш. Перекрестный иммунитет при этих болезнях не возникает. Возбудитель паракоклюша можно отличить от B.pertussis по культуральным, биохимическим и антигенным свойствам. Иммунопрофилактика паракоклюша не разработана.
Источник
ордетелла — Ф. К. Черкес [1986 Черкес Ф.К., Богоявленская Л.Б., Бельская Н.А.
Бордетелла — Ф. К. Черкес
Глава 31. Возбудители коклюша и паракоклюша
Возбудители этих заболеваний относятся к роду Bordetella.
1. Bordetella pertussis — возбудитель коклюша, описан Борде и Жангу в 1906 г.
2. Bordetella parapertussis — возбудитель паракоклюша, описан Элдеринг и Кондрик в 1937 г.
3. Bordetella bronchiseptica — вызывает заболевание у животных. У человека эти бактерии вызывают бронхопневмонию с коклюшеподобным кашлем. Впервые у человека это заболевание описано Брауном в 1926 г. (встречается редко).
Морфология. Бактерии коклюша — мелкие палочки овоидной формы, 0,3-0,5 × 1-1,5 мкм. Возбудитель пара-коклюша несколько большей величины. Оба микроба не имеют спор, неподвижны. При специальной окраске видна капсула. Грамотрицательны. Более интенсивно окрашиваются по полюсам.
На ультрасрезах видны капсулоподобная оболочка, зерна валютина, в нуклеиде — вакуоли.
Культивирование. Возбудители коклюша и паракоклюша — аэробы. Прихотливы к питательным средам. Для их выращивания применяют среду Борде — Жангу (глицериново-картофельный агар с кровью). В настоящее время пользуются средой КУА (казеиново-угольный агар) — это полусинтетическая среда без крови. Источником аминокислот здесь является гидролизат казеина. Среда КУА отличается от среды Борде — Жангу более простым и доступным методом изготовления.
Для угнетения роста посторонней флоры к среде добавляют пенициллин по 0,25 — 0,5 ME на 1 мл среды или метициллин — 2,5-4 мкг на 1 мл. Пенициллин можно наносить на поверхность среды в чашках.
Засеянные среды инкубируют в термостате при температуре 35-36° С, рН среды 6,8-7,4. Посевы необходимо предохранять от высыхания, для этого в термостат ставят сосуд с водой.
Колонии В. pertussis появляются через 48-72 ч, а В. parapertussis — через 24-48 ч.
На среде КУА колонии В. pertussis мелкие 1-2 мм в диаметре, В. parapertussis несколько крупнее. Колонии обоих микробов блестящие, серовато-кремового цвета (на казеиново-угольном агаре они напоминают капельки ртути). При снятии колоний остается вязкий, сметанообразный след. При изучении колоний в стереоскопическом микроскопе виден световой конус (колонии отбрасывают тень). Когда меняется положение светового источника (электролампочки) тень меняет положением Наличие светового конуса (хвостика) имеет диагностическое значение.
В. parapertussis образует фермент тирозиназу, поэтому в средах, содержащих тирозин, происходит его расщепление и среда окрашивается в коричневый цвет. Изменение цвета среды является дифференциально-диагностическим признаком.
В жидкой среде бактерии коклюша и паракоклюша образуют равномерную муть и придонный осадок. На агаре с кровью они дают зону гемолиза.
Свежевыделенные культуры чаще всего имеют гладкую S-форму (I фаза). При культивировании в неблагоприятных условиях или в материале, взятом в поздние сроки заболевания, могут появиться диссоциированные формы (II-IV фазы).
Ферментативные свойства. Возбудители коклюша не расщепляют углеводы и не ферментируют белки. Бактерии паракоклюша образуют ферменты уреазу и тирозиназу.
Бактерии коклюша и паракоклюша продуцируют ферменты патогенности: гиалуронидазу, плазмокоагулазу и лецитиназу.
Токсинообразование. В опытах на животных у коклюшной палочки были выявлены четыре типа токсина белковой природы: 1) термолабильный дермонекротический токсин; 2) термостабильный эндотоксин; 3) лейкоцитозостимулирующий фактор (стимулирующий лейкоцитоз); парентеральное введение его вызывало гибель экспериментальных животных; 4) гистаминсенсибилизирующий фактор — при введении его мышам у них повышалась чувствительность к гистамину.
Первые два типа токсина свойственны и возбудителю паракоклюша.

Таблица 47. Дифференциальные признаки бактерий рода Bordetella
Антигенная структура. У бактерий рода Bordetella сложная антиренная структура. Наиболее важными антигенами для лабораторной диагностики являются агглютиногены. Родовым агглютиногеном является 7. Видоспецифическим агглютиногеном для бордетелл коклюша является 1, для бордетелл паракоклюша — 14, для бордетелл бронхосептика — 12.
Моноспецифические сыворотки 1, 14, 12 используются для дифференциации видов (сыворотки выпускает Институт эпидемиологии и микробиологии им. Н. Ф. Гамалеи).
Кроме видоспецифических антигенов, у представителей Bordetella имеются и другие агглютиногены, разное сочетание которых определяет серовар (табл. 48.).

Таблица 48. Схема состава агглютиногенного рода бордетелл
По сочетанию трех главных агглютиногенов 1,2,3, определяемых в реакции агглютинации с моноспецифическими сыворотками, В. pertussis различают три серовара: 1,2,3; 1,2,0; 1,0,3.
Устойчивость к факторам окружающей среды. Возбудители коклюша и паракоклюша мало устойчивы. При температуре 56° С они погибают через 20-30 мин. Низкие температуры также губительно на них действуют. Прямой солнечный свет убивает их через 1-2 ч; УФ-лучи — через несколько минут. В сухой мокроте эти бактерии сохраняются в течение нескольких часов. Обычные растворы дезинфицирующих веществ губят их быстро.
Оба вида микробов мало чувствительны к антибиотикам, не чувствительны к пенициллину.
Восприимчивость животных. В естественных условиях животные не восприимчивы к возбудителям этого рода. В экспериментальных условиях удается воспроизвести коклюш у обезьян и молодых собак, вызвать гибель мышей.
Источники инфекции. Больной человек. Особенно заразны больные в катаральном периоде.
Пути передачи. Воздушно-капельный путь. Роль различных предметов мало вероятна ввиду неустойчивости коклюшных бактерий во внешней среде.
Патогенез. Возбудители коклюша и паракоклюша вызывают острое заболевание, сопровождающееся конвульсивным кашлем. Попав на слизистую оболочку верхних дыхательных путей, бактерии размножаются там и частично разрушаются. Выделившийся токсин действует на центральную нервную систему, раздражает нервные рецепторы слизистой оболочки верхних дыхательных путей, что приводит в действие кашлевой рефлекс. В результате возникают приступы судорожного кашля. В процессе заболевания наблюдается несколько периодов: катаральный, спазматического кашля и разрешения процесса.
Иммунитет. После перенесенного заболевания вырабатывается стойкий иммунитет, который обусловливается гуморальными и клеточными факторами.
Профилактика. Выявление и изоляция больных. Ослабленным детям, находившимся в контакте с больным коклюшем, вводят иммуноглобулин. Основные меры специфической профилактики — иммунизация детей АКДС (коклюшно-дифтерийно-столбнячной вакциной). Вакцину вводят троекратно в возрасте до 6 мес с последующей ревакцинацией.
Лечение. В ранних стадиях заболевания применяют противококлюшный иммуноглобулин. Для лечения используют эритромицин и ампициллин.
Контрольные вопросы
1. Опишите морфологические свойства возбудителя коклюша и паракоклюша.
2. На каких средах и каков характер роста коклюшных и паракоклюшных микробов?
3. Устойчивость возбудителей коклюша и паракоклюша во внешней среде.
4. Дифференциальные признаки возбудителей коклюша и паракоклюша.
5. Источники заражения, пути передачи, патогенез коклюша.
Микробиологическое исследование
Цель исследования: выявление возбудителя и дифференциация возбудителей коклюша от паракоклюша.
Материал для исследования
Отделяемое слизистой оболочки носоглотки.
Способы сбора материала

Способы сбора материала
Основной метод исследования
Микробиологический
Ход исследования
Первый день исследования

Первый день исследования
Второй — третий дни исследования
Посевы вынимают из термостата и просматривают, пользуясь лупой или стереоскопическим бинокулярным микроскопом. При наличии подозрительных колоний их выделяют на КУА: в чашках Петри, разделенных на сектора, или в пробирках. Посевы ставят в термостат. Если колоний много, из части их можно сделать мазки, покрасить и посмотреть под микроскопом. При наличии мелких грамотрицательных палочек ставят пробную реакцию агглютинации с моноспецифической родовой сывороткой 7. Положительная реакция агглютинации свидетельствует о принадлежности выделенной культуры к роду Bordetella. Для определения вида бордетелл ставят реакцию агглютинации с моноспецифическими видовыми сыворотками 1 и 14. Реакции ставят на предметном стекле. Положительный результат реакции агглютинации позволяет дать предварительный ответ.
Четвертый день исследования
Посевы вынимают из термостата и просматривают: сначала невооруженным глазом, обращая внимание на Цвет среды (нет ли коричневого окрашивания), затем изучают рост при помощи стереоскопического микроскопа.
При наличии подозрительных колоний из выделенной культуры делают мазки, окрашивают по Граму и изучают под микроскопом. Затем повторно (из чистой культуры) ставят реакцию агглютинации на стекле с моноспецифическими сыворотками 1,2,3 и 14. Результаты агглютинации дают возможность отдифференцировать В. pertussis от В. parapertussis, и если это — В. pertussis, то определить серовар: 1-й серовар — (1,2,3), 2-й серовар — (1,2,0), 3-й серовар — (1,0,3). Определение серовара имеет эпидемиологическое значение.
Для окончательной идентификации выделенной культуры (при положительной агглютинации с моноспецифическими сыворотками) ставят пробу на наличие уреазы и производят посев на скошенный агар, содержащий 0,1% тирозина (см. рис. 49).

Рис. 49. Схема выделения и идентификации возбудителей коклюша и паракоклюша (Bordetella pertussis и Bordetella parapertussis)
Проба на уреазу. В маленькую пробирку наливают 0,3-0,4 мл 2% раствора мочевины, вносят петлю культуры и добавляют 2-3 капли фенолфталеина. Пробирку встряхивают и ставят в термостат. Учитывают реакцию через 2 и 24 ч. Бактерии коклюша не изменяют цвет среды. Бактерии паракоклюша обладают ферментом уреазой, который расщепляют мочевину с образованием аммиака. Аммиак изменяет индикатор и среда окрашивается в красный цвет.
Проба с тирозином. На скошенный МПА в пробирках с 0,1% тирозином засевают выделенную культуру и ставят в термостат. На следующий день вынимают пробирку из термостата и просматривают ее. Наличие роста в пробирке и окрашивание среды в коричневый цвет свидетельствуют о росте возбудителей паракоклюша. Возбудители коклюша на этой среде не растут.
Пятый день исследования
При отсутствии подозрительных колоний дают отрицательный ответ.
Ускоренная диагностика
При бактериологическом методе исследования ответ можно получить через 3-4 дня.
1. Применение иммунно-люминесцентного метода позволяет дать ответ через несколько часов после взятия материала путем непосредственного выявления микробов в мазках, сделанных с тампонов.
2. Из посевов на среде КУА при отсутствии видимого роста можно сделать мазок-отпечаток: для этого стерильной резиновой пробкой дотрагиваются до места посева и переносят отпечаток на предметное стекло. Мазок-отпечаток изучают методом иммунофлюоресценции. В мазках обнаруживаются бактерии В. pertussis или В. parapertussis.
Контрольные вопросы
1. Что служит материалом для исследования при подозрении на коклюш?
2. Какие методы сбора материала применяют для выявления возбудителя при подозрении на коклюш?
3. Что прибавляют к среде для подавления роста посторонней микрофлоры?
Задание
1. Возьмите 10 чашек со средой КУА, флакон пенициллина, содержащий 300000 ЕД. Сделайте разведение пенициллина таким образом, чтобы в 0,1 мл содержалось 7,5 ЕД. Сделайте расчет на общее количество среды.
2. Соберите отделяемое носоглотки друг у друга и сделайте посев на среду КУА.
3. Возьмите у преподавателя чашку с культурой бактерий коклюша или паракоклюша, изучите характер колоний с помощью стереоскопического микроскопа. Подозрительные колонии посейте на сектор среды КУА (выделение чистой культуры).
4. Возьмите у преподавателя чистую культуру возбудителей коклюша или паракоклюша, выросшую на секторе среды КУА, и поставьте реакцию агглютинации с диагностической коклюшной сывороткой.
При наличии положительной реакции агглютинации поставьте пробу на уреазу и сделайте посев на среду с тирозином (0,1%).
Питательные среды
КУА. Среду готовит Институт эпидемиологии и микробиологии им. Н. Ф. Гамалея. Готовая среда КУА черного цвета, конденсационная вода не должна содержать частиц угля. В готовом виде среду можно сохранять продолжительное время (до месяца и более), предохраняя ее от высыхания.
Душевные интимные ласки обещаны абсолютно всем, кто снимет услуги качественной индивидуалкой с веб сайта https://prostitutkikrasnodaraonline.info. Для удобства выбора абонентов в разделе есть частные фото и видосы шлюх.
Источник