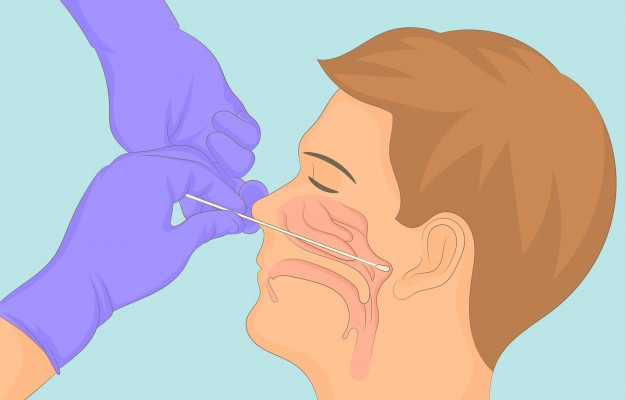
Мазок из носоглотки на коклюш алгоритм
Содержание статьи
Взятие материала из носоглотки на менингококк и коклюш
Цель: собрать материал для бактериологического исследования.
Показания:
обследование детей с подозрением на менингококковую инфекцию, коклюш;
обследование контактных в период карантина;
выявление бактерионосителей.
Противопоказания: нарушениецелостности слизистых оболочек верхних дыхательных путей.
Оснащение:
резиновые перчатки, маска;
стерильная пробирка с сухим ватным изогнутым тампоном (если тампон не изогнут, извлеките его на 2/3 длины и слегка изогните о внутреннюю стенку пробирки под углом ˚135 на расстоянии3-4 см от нижнего конца и вновь поместите в стерильную пробирку);
штатив для пробирок;
стерильный штапель в лотке;
бланк — направление в лабораторию.
Обязательные условия:
пробирки с тампоном на металлической петле хранить в холодильнике и использовать в течение 2-3 дней (на пробирке должна быть указана дата изготовления);
забор материала из носоглотки проводить натощак, до орошения или полоскания горла.
Этапы | Обоснование |
Подготовка к манипуляции | |
1. Объяснить маме/ребенку цель и ход предстоящей манипуляции, получить согласие | Обеспечение права на информацию, участие в исследовании |
2. Подготовить необходимое оснащение. Выписать направление в бактериологическую лабораторию | Обеспечение четкости выполнения исследования |
3. Вымыть и осушить руки, надеть маску, перчатки | Обеспечение инфекционной безопасности |
4. Поставить на инструментальный столик необходимое оснащение (расположив по правую руку) | Создание удобства для проведения исследования |
5. Усадить ребенка лицом к источнику света и при необходимости зафиксировать его с помощью помощника: а) ноги ребенка помощник обхватывает своими ногами; б) руки и туловище фиксирует одной рукой; в) голову держит, положив ладонь другой руки на лоб ребенку | Необходимое условие для проведения исследования |
Выполнение манипуляции | |
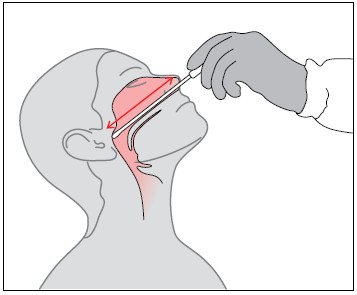
1. Попросить ребенка широко открыть рот и штапелем нажать на корень языка Примечание: ребенку младшего возраста открыть рот с помощью шпателя, взяв его как писчее перо левой рукой, ввести в ротовую полость до зубов, повернуть ребром и провести по боковой поверхности десен до места окончания зубов, после чего перевернуть его плашмя, поместить на корень языка и резко нажать на него | Обеспечение доступа для проведения исследования |
2. Извлечь ватный тампон из пробирки, взяв его правой рукой за пробку, в которую он вмонтирован | Обеспечение достоверности результата |
3.Осторожно, не касаясь языка, зубов, слизистой оболочки полости рта, ввести тампон по штапелю: — изогнутым концом вверх, под мягкое небо (за язычок) в носоглотку при обследовании на менингококк; — изогнутым концом вниз по задней стенке при обследовании на коклюш | Место максимальной локализации данных бактерий |
4. Двумя-тремя легкими движениями собрать слизь с задней стенки глотки | Условие, обеспечивающее эффективность |
5.Извлечь тампон из ротовой полости и поместить в пробирку, не касаясь ее краев | Обеспечение достоверности результата |
Завершение манипуляции | |
1.Вымыть и обработать антисептическим раствором руки в перчатках, снять их. Вымыть и осушить руки. | Обеспечение инфекционной безопасности |
2. На менингококк — немедленно отправить материал в бактериологическую лабораторию в сопровождении направления при температуре 36-39˚С (в контейнерах с грелками). На коклюш — доставить в бактериологическую лабораторию не позднее 5 ч после забора материала | Обеспечение достоверности исследования. Менингококк и палочка Борде-Жангу неустойчивы во внешней среде |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Коклюш
Коклюш, паракоклюш, бронхисептикоз.
Коклюш — заболевание, продолжающееся минимум две недели, без явлений интоксикации и повышения температуры тела, протекающее с приступообразным кашлем, усиливающимся ночью и по утрам, сопровождающимся покраснением лица, шумными вдохами (репризами), заканчивающимся отхождением вязкой слизи или рвотой в конце приступа кашля.
Осложнения коклюша:
Специфические: эмфизема легких, эмфизема средостения и подкожной клетчатки, ателектазы, коклюшная пневмония, нарушения ритма дыхания (задержки дыхания — до 30 с; остановки — апноэ — более 30 с), нарушение мозгового кровообращения, кровотечения (из носа, заднеглоточного пространства, бронхов, наружного слухового прохода), кровоизлияния (в кожу и слизистые оболочки, склеру и сетчатку глаз, головной и спинной мозг), грыжи (пупочная, паховая), выпадение слизистой оболочки прямой кишки, разрывы барабанной перепонки и диафрагмы.
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры (пневмония, бронхит, ангина, лимфаденит, отит и др.). Резидуальные явления: хронические бронхолегочные заболевания (хронический бронхит, бронхоэктатическая болезнь); задержка психомоторного развития, неврозы, судорожный синдром, различные речевые расстройства; энурез; редко — слепота, глухота, парезы, параличи.
Лабораторная диагностика
Лабораторные исследования проводят с диагностической целью и по эпидемическим показаниям:
1) с диагностической целью:
— детям, кашляющим в течение 7 дней и более, независимо от указаний на контакт с больным коклюшем;
— детям с подозрением на коклюш и коклюшеподобные заболевания по клиническим данным; — взрослым с подозрением на коклюш и коклюшеподобные заболевания, работающим в родильных домах, детских больницах, санаториях, детских образовательных учреждениях и школах, в т.ч. закрытого типа;
2) по эпидемическим показаниям (лицам, бывшим в контакте с больным):
— детям, посещающим детские образовательные учреждения, находящимся в детских больницах, санаториях, в которых были выявлены больные коклюшем/паракоклюшем, а также всем детям до 14 лет, общавшимся с больным коклюшем/паракоклюшем в домашних условиях;
— взрослым, работающим в указанных выше детских учреждениях, при выявлении в них больных коклюшем/паракоклюшем, а также при общении с больным коклюшем/паракоклюшем в домашних условиях.
Диагноз «коклюш, вызванный B. pertussis» ставится при подтверждении клинического диагноза «коклюш» хотя бы одним из указанных методов:
— выделение культуры B. pertussis; — обнаружение специфического фрагмента генома B. pertussis методом ПЦР; — у привитых детей и взрослых: выраженная сероконверсия, т.е. увеличение или уменьшение в 4 и более раз уровня специфических IgG и/или IgA (ИФА) или уровня агглютинирующих антител (РА) при исследовании парных сывороток, взятых с интервалом не менее 2 недель;
— у взрослых: допустимо однократное обнаружение специфических IgM (ИФА); — у непривитых детей: однократное обнаружение специфических IgM, и/или IgA, и/или IgG (ИФА) или антител в титре 1/80 и более (РА).
Диагноз «коклюш, вызванный B. parapertussis» ставится в случае: — выделения культуры B. parapertussis; — или при обнаружении фрагмента генома B. parapertussis методом ПЦР;
— или при обнаружении антител к B. parapertussis методом РА в титре не менее 1/80.
Диагноз «бронхисептикоз» ставится при выделении культуры B. bronchiseptica или при обнаружении специфического фрагмента генома B. bronchiseptica методом ПЦР.
Обследование методом ПЦР нередко оказывается эффективнее бактериологического метода в более поздние сроки заболевания и на фоне лечения антибиотиками.
Материал для исследования:
1.мазки со слизистой нижнего носового хода и задней стенки ротоглотки
2. культуры микроорганизмов.
Взятие мазков со слизистой нижнего носового хода
Мазки берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе. Если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание. Зонд вводят легким движением по наружной стенке носа на глубину 2-3 см до нижней раковины. Затем зонд слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину до носоглотки, делают вращательное движение и удаляют вдоль наружной стенки носа.После взятия материала тампон (рабочую часть зонда с тампоном) помещают до места слома в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков. Конец зонда отламывают с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают и маркируют.
Взятие мазков из ротоглотки
Мазки из ротоглотки берут сухими стерильными зондами с вискозными тампонами вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки.
После взятия материала тампон (рабочую часть зонда с вискозным тампоном) помещают в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков. Конец зонда отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку. Пробирку с раствором и рабочей частью зонда закрывают, маркируют.
Хранение
Допускается хранение клинического материала до проведения исследования в течение 3 суток при температуре от 2 до 8 °С или 1 неделю — при температуре не выше минус 16 °С.
Источник
Взятие мазка из зева и носа: на дифтерию, менингит, коронавируc
Взятие мазка из зева и носа проводится с целью бактериологического и вирусологического исследования для определения возбудителя заболевания. Мазок берут при подозрении на дифтерию, менингококковую инфекцию и новую коронавирусную инфекцию COVID-19 (SARS-CoV-2). Диагностика проводится разными методами: бактериологическими и ПРЦ (метод полимеразной цепной реакции). Для медицинской сестры важно правильно взять мазок, чтобы результат исследования был достоверным.

Оглавление
- Показания и противопоказания
- Оснащение
- Алгоритм процедуры
- Хранение и отправка материала
- Правила забора проб на SARS-CoV-2
Взятие мазка из зева и носа: показания и противопоказания
Цели взятия мазков из зева и носа следующие:
- выявление возбудителя заболевания
- выявление бактерионосительства
- определение чувствительности микрофлоры ротоглотки и носоглотки к антибиотикам
Показания для манипуляции:
- ангина, в особенности — при наличии патологического выпота на миндалинах
- паратонзиллит
- паратонзилляный (заглоточный) абсцесс
- инфекционный мононуклеоз
- стенозирующий ларингит, ларинготрахеит
- подозрение на носительство стрептококковой и стафилококковой инфекции
- подозрение на дифтерию
- контакт с больным дифтерией
- подозрение на коклюш
- контакт с больным коклюшем
- подозрение на менингит
- контакт с больным менингитом
- подозрение на коронавирусную инфекцию
- контакт с больным COVID-19
Противопоказания:
абсолютных — нет. Относительные:
- невозможность открыть рот
- травмы, ожоги лица
- анатомический дефект костей черепа
- геморрагический диатез в тяжелой форме
Оснащение для проведения манипуляции
Для взятия мазка из зева и носа необходимо подготовить:
- средства индивидуальной защиты (СИЗ) для медицинского работника — одноразовый дополнительный халат, шапочка, маска или респиратор, защитные очки или щиток, двойные перчатки
- бланк направления на исследование
- штатив для пробирок
- стерильные зонды-тампоны
- пробирки с транспортной средой
- стерильный шпатель
- стеклограф или нестираемый маркер
- емкости с дезинфицирующими растворами
Набор для взятия мазка
Перед выполнением процедуры следует подготовить набор для забора мазка. Тип микроорганизма и планируемый тест определяют тип зонда-тампона и субстрата.
Для забора материала для исследования методом ПЦР следует использовать только зонды-тампоны с синтетическим волокном, намотанным на пластиковый стержень (другие могут вызвать ингибирование ПЦР). Нельзя использовать зонды-тампоны из органическим материалов (напр. хлопка, дерева) или с альгината кальция, поскольку они могут ингибировать ПЦР.
Кроме того, при взятии мазка в направлении коклюша не следует использовать хлопковые тампоны или тампоны из искусственного шелка (района). Полиэстеровые, дакроновые или нейлоновые тампоны на пластиковом стержне, вероятно, являются универсальными. На стержне зонда-тампона имеется: заводская отметка глубины, на которую он должен быть вставлен, и сужение, на котором его следует сломать после опускания в пробирку.
В случае диагностики на наличие SARS-CoV-2 можно использовать:
- коммерческие наборы — содержат гибкий флокированный пластиковый зонд и пробирку с вирусологической средой
- наборы home made (для мазков из горла и носа), содержащие:
- стерильные флокированные или стандартные пластиковые зонды-тампоны с тампонами из дакрона, вискозы или искусственного шелка
- пробирки со стерильным забуференным 0,9 % раствором NaCl в объеме, позволяющем погрузить конец зонда-тампона (рис. 1).
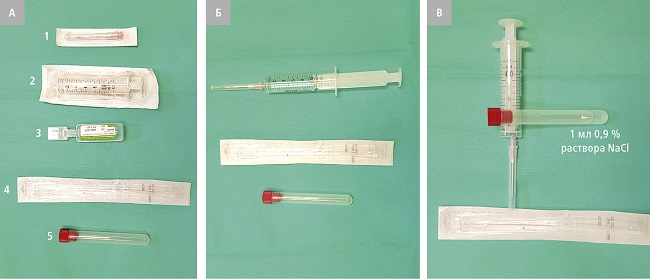
Рисунок 1. A — оборудование, необходимое для приготовления набора home made: 1 — игла для набирания 0,9 % раствора NaCl, 2 — шприц, 3 -небольшая упаковка с 0,9 % раствором NaCl (следует использовать небольшие упаковки, чтобы избежать контаминации раствора при его многократном использовании), 4 — зонд-тампон, 5 — пробирка. Б — 0,9 % раствор NaCl должен быть набран в шприц в асептических условиях. В — примерно 1 мл раствора следует налить в пробирку, в которую после взятия мазка будет помещен зонд-тампон
Перед взятием мазка следует описать пробирку, в которую будет помещен зонд-тампон, и наклеить на нее код (если требуется; рис. 2).
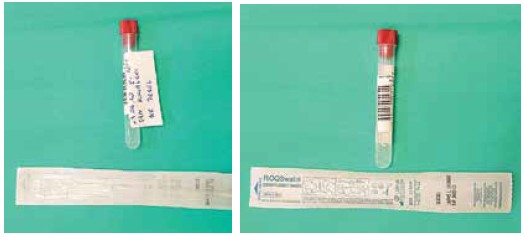
Рисунок 2. Описание и приклеивание кода на пробирку. На пробирке должна быть указана следующая информация: имя и фамилия пациента, дата рождения, дата и время взятия мазка
Взятие мазка из зева и носа: алгоритм
При заборе материала важно! правильно держать зонд — между большим пальцем и остальными пальцами кисти, взяв его в руку, как писчее перо:
- Вымыть руки гигиеническим способом
- Надеть средства индивидуальной защиты
- Представиться пациенту
- Идентифицировать личность пациента
- Убедиться в наличии информированного согласия на проведение процедуры
- Объяснить пациенту цель и ход процедуры
- Заполнить бланк направления на исследование
- Промаркировать пробирки
- Предложить пациенту удобно сесть лицом к источнику света
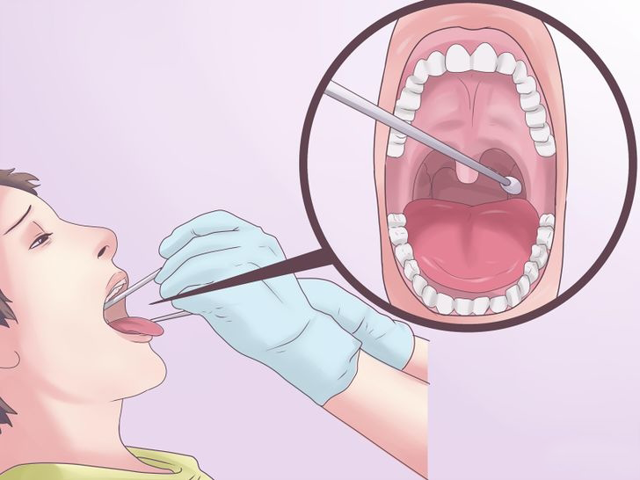
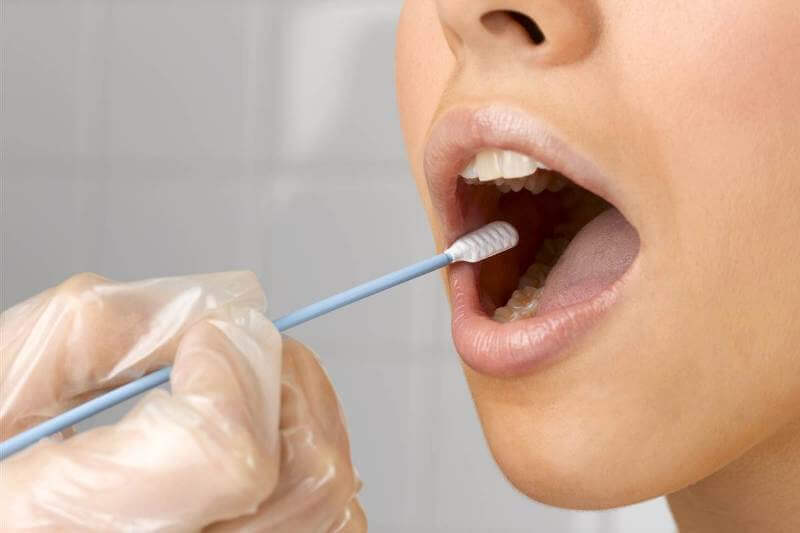
Взятие мазка из зева
Материал из зева и ротоглотки на дифтерию, коклюш, коронавирус, менингит, стафилло- и стрептококки следует забирать натощак и до приема лекарств либо не ранее, чем через 2 часа после приема пищи. Методика следующая:
- Попросить пациента слегка запрокинуть голову
- Взять в левую руку пробирку со стерильным влажным зондом и стерильный шпатель
- Попросить пациента открыть рот
- Левой рукой надавить на корень языка, правой — извлечь из пробирки стерильный зонд
- Не касаясь зубов, слизистой языка и щёк, вращательными движениями провести зондом по дужкам и миндалинам, при необходимости — задней стенке ротоглотки. При взятии мазка на коклюш, коронавирус, менингит, носительство стрептококковой и стафилококковой инфекций — обязательно с задней стенки ротоглотки! Если имеются налёты — провести по границе здоровой и пораженной ткани, слегка нажимая на них зондом
- Извлечь зонд и сразу поместить его в пробирку, не касаясь её стенок
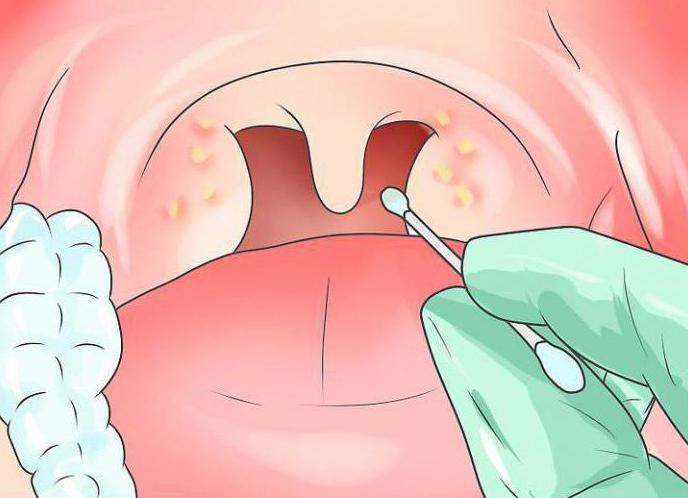
Взятие мазка из носа
- Попросить пациента очистить носовые ходы и слегка запрокинуть голову
- Взять в левую руку пробирку с сухим зондом, правой — извлечь сухой зонд из пробирки
- Передний назальный мазок. Легким вращательным движением ввести зонд в левый носовой ход по наружной стенке носа на глубину 1-3 см до нижней носовой раковины. Не касаться кожи крыльев носа!
- Назальный мазок с задней стенки глотки. Применяется при заборе материала на SARS-CoV-2 (возбудитель коронавирусной инфекции). Техника меняется. После введения зонда на 1-3 см зонд слегка опустить книзу, аккуратно ввести под нижнюю носовую раковину до задней стенки носоглотки (на 3-4 см у детей и 5-6 см у взрослых). Извлечь зонд также вращательными движениями.
- Не касаясь краёв пробирки, поместить в нее зонд.
Взятие мазков из зева и носа на SARS-CoV-2 осуществляется специальными зондами. После забора материала конец каждого зонда отламывают и помещают в микропробирку типа эппендорф. Важно! Оба зонда — с материалом как из ротоглотки, так и из носоглотки — помещают в одну пробирку с крышкой для большей концентрации вирусов.
Отправка материала в лабораторию
Пробирки помещают в термос или термоконтейнер с хладоэлементами. Температура хранения материала — от +2ºC до +8ºC, время хранения — до 24 часов.
Пробирка должна быть правильно упакована. Правила упаковки образцов должны соответствовать 2-му уровню биологической безопасности (BSL2), а контейнеры должны быть упакованы и описаны в соответствии с принципами для агентов, вызывающих заболевания у людей. Применяется принцип тройной упаковки (1 — основной контейнер, 2 — вторичная упаковка, 3 — внешняя упаковка).
Наружная поверхность основного контейнера должна рассматриваться как контаминированная, поэтому ее следует помещать во вторичную упаковку таким образом, чтобы минимизировать риск контаминации вторичной упаковки. В зависимости от процедур, используемых в данном учреждении, и количества людей, принимающих участие в заборе мазка и упаковке образцов, отдельные этапы процедуры могут отличаться. Например, если образцы берут в доме пациента и всю процедуру выполняет только один человек, то перед тем, как поместить основной контейнер во вторичную упаковку, он должен покинуть дом пациента, деконтаминировать руки, снять внешние перчатки и внешний халат, снова деконтаминировать руки, надеть новую пару перчаток, продезинфицировать их, поместить основной контейнер во вторичную упаковку, плотно закрыть ее, продезинфицировать руки, а затем внешнюю поверхность вторичной упаковки.
Вторичная упаковка должна содержать абсорбирующий слой, который будет абсорбировать жидкость при разгерметизации пробирки.
Направления, прикрепленные к образцам, не могут быть помещены во вторичную упаковку, но они должны быть помещены в запечатанный конверт, прикрепленный к внешней упаковке.
Надеемся, взятие мазка из зева и носа не вызовет у вас трудностей, а станет легко выполняемым навыком, которым должна владеть каждая медицинская сестра.
Правила забора материала на SARS-CoV-2 (презентация)











СКАЧАТЬ ПРЕЗЕНТАЦИЮ
Источники:
- https://mosgorzdrav.ru/
- https://empendium.com/
Источник
Bordetella pertussis, ДНК [ПЦР]
[09-038] Bordetella pertussis, ДНК [ПЦР]
425 руб.
Выявление возбудителя коклюша (Bordetella pertussis), в ходе которого с помощью метода полимеразной цепной реакции определяется генетический материал (ДНК) микроорганизма в биоматериале.
Синонимы русские
Палочка коклюша, бактерия Борде — Жангу [полимеразная цепная реакция].
Синонимы английские
Whooping cough, B. pertussis, DNA [Polymerase chain reaction].
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из носоглотки, мазок из зева (ротоглотки).
Как правильно подготовиться к исследованию?
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
Bordetella pertussis (B. pertussis) — это грамотрицательная аэробная коккобацилла, являющаяся возбудителем коклюша. Инфекция передается воздушно-капельным путем. Риск заболеть наиболее высок у не вакцинированных АКДС детей и беременных женщин. Следует отметить, что прививка АКДС не обеспечивает стопроцентную защиту от заражения, так как иммунный ответ постепенно угасает в течение 1-3 лет после вакцинации. В этой связи подростки и взрослые, вакцинированные более чем 3 года назад и находившиеся в тесном контакте с больным коклюшом или носителем B. pertussis, также подвергаются риску заражения.
В клинической практике применяют несколько лабораторных тестов для диагностики коклюша: посев на питательную среду, метод прямой иммунофлюоресценции (ПИФ), серологические методы и исследование с помощью полимеразной цепной реакции (ПЦР). ПЦР — метод молекулярной диагностики, позволяющий выявлять в биологическом материале (например, в носоглоточном аспирате) фрагменты генетического материала (ДНК) возбудителя инфекции и наиболее точно и быстро диагностировать коклюш.
Специфичность ПЦР достигает 100 %, что обусловлено использованием в реакции специфичной именно для B. pertussis пары праймеров. Положительный результат у пациента с признаками поражения респираторного тракта позволяет подтвердить диагноз «коклюш» и исключить наличие других бактериальных (в том числе паракоклюша) и вирусных заболеваний.
Исследование с помощью ПЦР характеризуется высокой чувствительностью, превосходящей чувствительность бактериологического метода, ПИФ и реакции непрямой гемагглютинации (РНГА). Следует, однако, заметить, что она зависит от клинической стадии заболевания, в которую был взят биоматериал, от возраста пациента и предшествующего лечения.
В течении коклюша можно выделить 4 стадии: инкубационный период, катаральную, пароксизмальную стадию и стадию выздоровления. ПЦР является предпочтительным методом идентификации возбудителя при подозрении на коклюш в катаральную и раннюю пароксизмальную стадию (около 4 недель после появления первых симптомов). В этот период чувствительность ПЦР максимальна и превосходит чувствительность бактериологического метода. По прошествии более 3-4 недель чувствительность ПЦР несколько снижается. Это имеет особое значение при диагностике заболевания у взрослых пациентов, которые, как правило, игнорируют первые симптомы болезни, характерные для катаральной стадии, и обращаются за помощью в более поздние сроки, в пароксизмальную стадию. При диагностике коклюша в позднюю пароксизмальную стадию и при выздоровлении наиболее точные результаты будут получены при комбинации серологических исследований (например, РНГА) и исследования с помощью ПЦР.
Также ПЦР оптимальна для диагностики коклюша у младенцев, хотя у детей старшего возраста, а также подростков и взрослых она характеризуется большим числом ложноотрицательных результатов. Так, ее чувствительность при взятии биоматериала в первые 10 дней болезни в возрастных группах до 1 года, 1-4 года и старше 5 лет составила 70, 50 и 10 % (для сравнения: чувствительность «золотого стандарта» диагностики коклюша — посева на питательную среду — в этот период не превышает 60 %). В качестве биоматериала для диагностики коклюша у младенцев предпочтителен носоглоточный аспират. У детей старшего возраста, подростков и взрослых берут мазки из носоглотки и зева. Использование тампона из кальция альгината в этом случае не рекомендуется.
В отличие от других лабораторных методов, точность ПЦР в меньшей степени зависит от приема антибактериальных препаратов. Так, чувствительность метода при взятии биоматериала на 4-й день лечения эритромицином составила 89 % (бактериологического посева — 56 %), на 7-й день — 56 % (посева — 0). Поэтому ПЦР чаще выбирают для выявления B. pertussis у пациентов в катаральной стадии заболевания, если биоматериал сдается на фоне начатого лечения. Результаты теста при сдаче биоматериала на фоне лечения в пароксизмальную стадию во многих случаях ложноотрицательные.
Исследование с помощью ПЦР с успехом применяется у вакцинированных АКДС пациентов. При этом идентификация B. pertussis в мазках этой группы может означать транзиторное носительство, но не активную инфекцию, поэтому результаты ПЦР рекомендуется оценивать с помощью дополнительных эпидемиологических, клинических и лабораторных данных.
Для чего используется исследование?
- Для диагностики коклюша, особенно у младенцев в период катаральной и ранней пароксизмальной стадии заболевания.
Когда назначается исследование?
- При симптомах коклюша в катаральной стадии: лихорадка, насморк, заложенность носа, слезотечение.
- При симптомах коклюша в пароксизмальной стадии: приступы интенсивного кашля, сопровождающиеся глубоким свистящим вдохом, рвотой, цианозом кожи лица.
- При обследовании пациента, находившегося в тесном контакте с больным коклюшем.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- коклюш;
- транзиторное носительство.
Причины отрицательного результата:
- отсутствие коклюша;
- ложноотрицательные результаты чаще наблюдаются при сдаче биоматериала в позднюю пароксизмальную стадию и стадию реконвалесценции, на фоне лечения антибиотиками.
Что может влиять на результат?
- Стадия заболевания — наиболее точный результат будет получен при сдаче анализа в первые 3-4 недели после начала заболевания.
- Возраст пациента — наиболее точный результат будет получен при обследовании пациентов в возрасте до 1 года.
- Применение эритромицина и других антибиотиков может приводить к ложноотрицательным результатам.
Важные замечания
- Анализ не предназначен для оценки эффективности лечения.
- Результат исследования следует оценивать с помощью дополнительных эпидемиологических, клинических и лабораторных данных.
Также рекомендуется
- Посев на Bordetella pertussis/parapertussis
- anti-Bordetella pertussis, anti-Bordetella parapertussis
- Лейкоцитарная формула
Кто назначает исследование?
Инфекционист, педиатр, пульмонолог, врач общей практики.
Литература
- Laboratory manual for the diagnosis of whooping cough caused by Bordetella pertussis / Bordetella parapertussis. World Health Organization. Dept. of Immunization, Vaccines and Biologicals. WHO/IVB/04.14, 2004.
- Müller FM, Hoppe JE, Wirsing von König CH. Laboratory diagnosis of pertussis: e of the art in 1997. J Clin Microbiol. 1997 Oct;35(10):2435-43.
- Riffelmann M, Wirsing von König CH, Caro V, Guiso N; Pertussis PCR Consesus Group. Nucleic Acid amplification tests for diagnosis of Bordetella infections. J Clin Microbiol. 2005 Oct;43(10):4925-9.
- Lind-Brandberg L, Welinder-Olsson C, Lagergård T, Taranger J, Trollfors B, Zackrisson G. Evaluation of PCR for diagnosis of Bordetella pertussis and Bordetella parapertussis infections. J Clin Microbiol. 1998 Mar;36(3):679-83.
- Dalby T, Krogfelt KA. Laboratory diagnosis of pertussis: agglutination is not suitable. Respirology. 2011 Nov;16(8):1160-2.
Источник