Корь это днк или рнк
Содержание статьи
Чем лечить коронавирус? Новые ответы вирусолога

Почему одни вирусы остаются локальными, а другие — становятся причиной пандемии? Можно ли предсказать пандемию? Когда мы получим вакцину и лекарство — и как они будут работать? Корреспондент «СПИД.ЦЕНТРа» Ника Воюцкая узнала ответы на эти вопросы у петербургского вирусолога и исполняющего обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого Андрея Васина.
— Давайте повторим для читателя еще раз, что вообще из себя представляет новый коронавирус?
— Новый коронавирус — SARS-Cov-2 — представитель одного из многочисленных семейств РНК-содержащих вирусов человека и животных. Вирус — это упакованная молекула нуклеиновой кислоты (ДНК или РНК). Для размножения вирус должен попасть в клетки хозяина, а он, в свою очередь, сопротивляется и вырабатывает механизм защиты, который вирус пытается обойти.
— Причем вирусы эволюционируют быстрее, чем клеточные организмы…
— Да. В этом их преимущество. Организм хозяина (например, человека) так быстро эволюционировать не может, потому что устроен сложнее. Каждый раз, когда появляется новый вирус или новая разновидность уже известного вируса, организму нужно время, чтобы выработать защиту.
Вирус заразил клетку — клетка выработала защиту против вируса — вирус накопил определенное количество ошибок в геноме, и какие-то из них позволили вирусу обойти защиту клетки — вирус размножается дальше. Эволюция, с точки зрения вирусологии, — это история войны клеточных организмов с вирусами, в результате которой и те и другие меняются и приспосабливаются друг к другу.
 Андрей Васин, вирусолог, исполняющий обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого, Санкт-Петербург.
Андрей Васин, вирусолог, исполняющий обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого, Санкт-Петербург.— Если вирусы такие классные, почему мы, люди, до сих пор живы?
— Вирусу выгодно инфицировать клетку, но не убивать ее. Где он будет дальше размножаться? 1918 год. «Испанка», новый вирус, к которому не было популяционного иммунитета. 50 млн человек умерли за один эпидемический сезон. Кто-то выжил — и приобрел иммунитет к «испанке». На следующий год заболевание у переболевших прошло в гораздо более легкой форме — потому что появился иммунитет к вирусу. Резюме: когда новый вирус попадает в популяцию, смертность от него высокая (но для разных вирусов разная: может быть 1–2 %, может — 50 %). Проходит время, вирус и организм адаптируются друг к другу, что приводит к снижению тяжести заболевания и летальности.
— Спрошу сразу: когда нам ожидать лекарство от нового коронавируса?
— Разрабатывать новое лекарство очень сложно и долго. Если не говорить о препаратах, созданных методами генной инженерии, а о традиционных низкомолекулярных лекарствах — на это может уйти около десяти лет и несколько миллиардов долларов.
Поэтому вместо изобретения нового лекарства от COVID-19 исследователи делают repurposing of the drugs — испытывают против нового коронавируса уже известные препараты. На первых этапах проводят скрининг с помощью биоинформатики и компьютерного моделирования. Дальше — экспериментальная проверка.
Так можно пропустить целый этап проверки безопасности и токсичности. Ученым остается лишь доказать, что препарат эффективен при этом заболевании и именно при этом заболевании не вызовет побочных эффектов.

Сейчас испытывается множество таких лекарств — четыре наиболее перспективных выбрала ВОЗ, но, вообще, их гораздо больше. Китай испытывает все подряд, от новейших разработок до традиционной китайской медицины, — вдруг сработает? У них есть такая возможность.
— А как вообще лекарство от одного вируса может победить другой вирус?
— Возьмем «Калетру» (Лопинавир + Ритонавир) — ингибитор протеазы ВИЧ — и один из препаратов, исследуемых сейчас ВОЗ для лечения коронавируса. Идея вот в чем: у коронавируса тоже есть фермент протеаза. Вдруг ингибитор протеазы ВИЧ проингибирует и протеазу нового вируса? То же касается и ингибиторов полимеразы (Ремдезивир, Фавипиравир) — фермента, который позволяет вирусам реплицировать свой геном.
— «Калетра» в китайском рандомизированном контролируемом исследовании показала себя неэффективной. Пациентов было 199. Это окончательный результат?
— Пациенты — неоднородная масса людей, и у всех заболевание протекает по-разному. Опасность исследования с маленькой выборкой в том, что в него теоретически могли попасть именно те люди, для которых препарат оказался малоэффективным. Или наоборот. А большая выборка может показать, что для другой группы пациентов препарат сработает. Поэтому нужно больше исследований.
— Как работает Ремдезивир — еще одно потенциальное лекарство от коронавируса? Читаю, что это ингибитор РНК-зависимой РНК-полимеразы, но не понимаю, что это значит.
— Цепочка РНК вируса состоит из нуклеотидов: A, C, U и G. РНК-полимераза — вирусный фермент, который эту цепочку распознает и копирует. Если мы добавляем модифицированное основание, оно распознается полимеразой и автоматически добавляется к цепочке как обычный нуклеотид. Но новый нуклеотид к этой цепочке присоединиться уже не может. Или свойства этой цепочки нарушаются. Так мы блокируем РНК-полимеразу, и вирус больше не реплицируется.
— Пока самые обнадеживающие новости — о Хлорохине и Гидроксихлорохине. Французские ученые успешно провели клиническое исследование Гидроксихлорохина в лечении COVID-19. Можно говорить о победе?
— Это дает надежду, но выводы делать рано. Нужны исследования с большей выборкой. Разница между эффективностью плацебо и препарата оказалась достоверной, но в исследовании участвовали всего 36 человек. Эти препараты успешно лечат малярию, но как они себя поведут и какие побочные действия дадут при лечении коронавируса — пока неизвестно.
— Есть еще терапия антителами. Как она работает и когда ее ждать?
— Что такое антитело? Это молекула, которая вырабатывается клетками иммунной системы и нейтрализует вирус. Можно сделать его искусственно и ввести человеку, остановив тем самым распространение вируса. Подход старый: на заре вирусологии брали кровь переболевшего человека и вводили больному — иногда помогало, но давало много побочных эффектов. Сейчас антитела находят, выделяют, очищают и делают из них препарат.
Антитело, которые мы получаем в лаборатории, может эффективно нейтрализовать вирус. Но это большая белковая молекула, и она может быть токсичной, дать серьезные побочные эффекты или просто потерять активность. Можно не синтезировать антитело в лаборатории, а сделать так, чтобы сам организм его синтезировал.
Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Но можно предположить, что пожизненного иммунитета к нему не будет.
Для этого определяем генетическую последовательность, кодирующую антитело, и «записываем» ее в молекулу мРНК. Эту молекулу вводим в организм. Там уже внутри клетки происходит трансляция молекулы мРНК, и антитело синтезируется в «естественных» условиях.
То есть мы делаем молекулу «кода», вводим в организм — и организм расшифровывает «код» и сам производит антитела. Молекулы РНК меньше размером, чем молекулы белка, стабильнее, гомогеннее по структуре и проще в производстве, чем молекулы антитела, — в этом их преимущество.
До конца пандемии разработать эффективную антительную терапию от COVID-19, а тем более на основе мРНК точно не получится. Но есть надежда, что пандемия SARS-CoV-2 ускорит развитие противовирусных иммунобиотехнологий и произойдет технологический рывок. И это позволит человечеству подойти к новой пандемии более подготовленным, чем к пандемии SARS-CoV-2.
—Насколько, вообще, часто появляются новые вирусы?
— Глобальные, как SARS-CoV-2, — не так уж часто. Ближайшая к нам сходная пандемия — та самая «испанка» 1918 года. Новый коронавирус — вторая крупная пандемия современного мира, потенциально сравнимая с «испанкой» по масштабу и скорости распространения (но не по смертности). Есть пандемия ВИЧ — но она растянута во времени. Была пандемия свиного гриппа 2009 года, но не столь опасная: вызвана новым вариантом вируса гриппа, но все же гриппом, против которого уже были препараты и технологии производства вакцин.
— Почему одни вирусы остаются локальными, а другие вызывают пандемию? Коронавирусы SARS или MERS не привели к пандемии. А ведь это относительно недалекое прошлое, когда было и авиасообщение, и высокая плотность населения в городах.
— Дело, скорее, в биологических свойствах конкретного вируса, а не в свойствах популяции. Чтобы вирус широко распространился, у него должно одновременно совпасть несколько характеристик: специфичность к рецептору на клетке, распространенность этого рецептора, эффективность репликации в данном типе клеток и многое другое.
При этом быстро распространиться могут только те вирусы, которые передаются воздушно-капельным и контактным путем. Вирус Эбола передавался с инфицированными биологическими жидкостями — поэтому его получилось локализовать. SARS и MERS также не обладали набором свойств для быстрого глобального распространения. А в новом коронавирусе «удачные» для распространения свойства совпали.
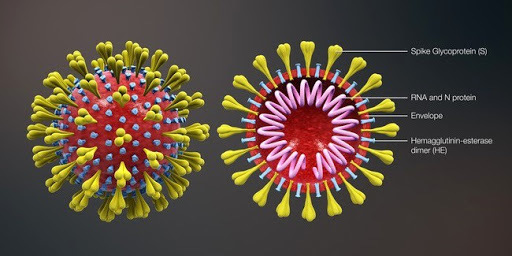 Строение коронавируса COVID-19, модель.
Строение коронавируса COVID-19, модель. — Можно ли предсказать пандемию?
— Какой из вирусов станет пандемическим и как он будет распространяться — нет, это процесс стохастический. Вирус быстро накапливает мутации, происходит изменение его характеристик и свойств. Это абсолютно случайный процесс, хотя и подверженный действию отбора. При этом было известно, что коронавирусы обладают пандемическим потенциалом, можно было ожидать, что один из них приведет к пандемии. Но невозможно было предсказать, когда это случится.
— Как определить, что вирус обладает пандемическим потенциалом?
— Новые вирусы человека не возникают ниоткуда — это зоонозный тип передачи: от летучих мышей, обезьян и кого угодно из животных, с кем у человека есть контакт. Если изучать вирусы, которые циркулируют среди животных, можно предположить, какие из них потенциально могут преодолеть межвидовой барьер и «перепрыгнуть» на человека. А они могут, если животное эволюционно близкое человеку (обезьяны) или у него есть общие гомологичные рецепторы (летучие мыши — панголины — человек).
Возьмем птичий грипп: высокопатогенный вирус гриппа птиц H5N1 преодолел межвидовой барьер. Но, к счастью, от человека к человеку не передавался. Вот если бы он мутировал так, что смог бы передаваться от человека к человеку, мы получили бы пандемию с очень высокой степенью летальности. Поэтому изучению гриппа птиц уделяют много внимания.
Так что есть постоянная угроза пандемии. Мы не можем предсказать ни время начала, ни источник, ни летальность. Это как с землетрясениями: может быть? Да. Повлиять или предсказать можем? Нет. Пандемия с высокой летальностью может случиться раз в сто лет, а может — раз в шестьсот. Или, может, через год будет новая.
— Будет ли иммунитет у тех, кто переболел новым коронавирусом?
— Коронавирусы человека не очень хорошо изучены: среди людей до настоящего времени встречались всего шесть представителей семейства. Четыре (OC43, HKU1, NL63 и 229E) вызывают обычные легкие респираторные инфекции и не были особо интересны исследователям. Еще два, SARS и MERS — вирусы атипичной пневмонии и ближневосточного респираторного синдрома, — изучались, но инфекции были ограниченными. Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Можно предположить, что раз этот вирус РНК-содержащий, то он является вариабельным, то есть быстро изменяющимся, — и пожизненного иммунитета к нему не будет. Скорее, длительность иммунитета будет как к гриппу, относительно короткой.
— Что будет, если те, кто переболел и выздоровел, заболеют снова? Статистика смертности от нового коронавируса значительно выше, чем от гриппа.
— Есть вероятность, что новый коронавирус станет сезонным и будет, как грипп, циркулировать и создавать ежегодные эпидемические вспышки. При этом чем дольше вирус будет циркулировать в популяции, чем больше людей переболеют им в первый раз, тем легче он будет переноситься. И тем ниже будет вероятность осложнений и смерти в результате заражения. Тогда уже можно будет сравнивать смертность от сезонного гриппа и сезонного коронавируса SARS-CoV-2.
Разработать вакцину быстро невозможно. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
«Пра-пра-прадедушкой» всех современных вирусов гриппа можно считать тот самый вирус «испанки» 1918 года. Со временем в результате мутаций и замен некоторых генов из него образовались циркулирующие в настоящее время вирусы гриппа А. Сначала «испанка» унесла жизни 50 млн человек, сейчас же смертность от гриппа относительно невысокая. Вирус «привык» к людям, иммунная система людей «привыкла» к вирусу. (Не стоит забывать и о вакцинации против гриппа!) Наше идеальное сосуществование с новым вирусом будет тогда, когда летальных случаев не будет, а еще лучше — не будет тяжелых случаев.
— Как быстро появится вакцина от SARS-CoV-2?
— Разработать вакцину быстро невозможно. Сейчас часто пишут, что с современными технологиями сделать новую вакцину можно быстро. Это не так. Что такое «разработать»? Сделать в лаборатории некую биологическую конструкцию, которая потенциально может защищать организм, — требует месяца-двух.
Но то, что создано in silico и получено в лаборатории, нужно испытать на животных. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
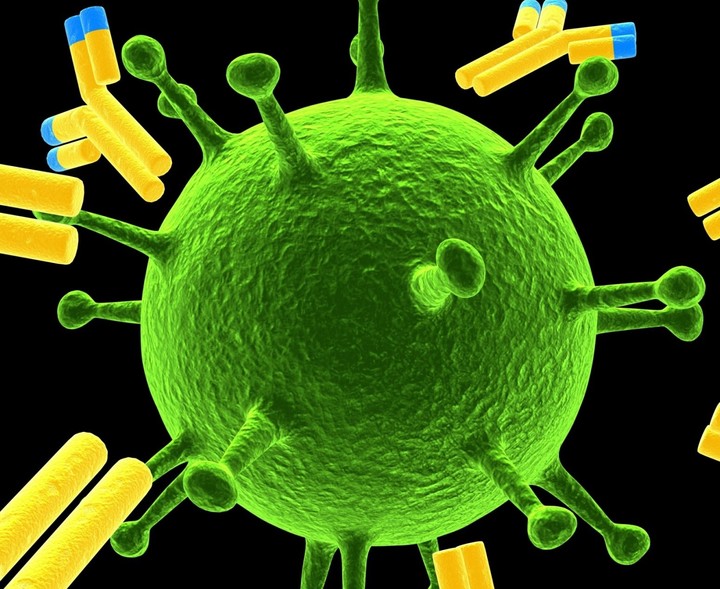 Антитела (или иммуноглобулины) — это особые белковые молекулы, вырабатываемые иммуной системой организма, для того, чтобы бороться с вирусами.
Антитела (или иммуноглобулины) — это особые белковые молекулы, вырабатываемые иммуной системой организма, для того, чтобы бороться с вирусами. На этом этапе вакцину испытывают по двум направлениям. Первое — безопасность. Второе — насколько она защищает от вируса. Для этого нужно использовать релевантную животную модель вирусной инфекции — то есть сначала адаптировать новый вирус к организму подопытного животного. Иногда адаптировать вирус получается быстро и легко, иногда нет. При этом развитие инфекции в животном должно имитировать человеческое. Если вирус респираторный — то и у лабораторного животного болезнь должна поражать органы дыхания.
— Как разрабатывается сама вакцина, ее формула? Тот самый первый этап, который теперь можно сделать за месяц.
— Можно ослабить или инактивировать вирус — это традиционный подход, но сейчас мало кто так делает — все делают генно-инженерные вакцины (векторные, рекомбинантные, ДНК, РНК). Для этого нужна только последовательность генома вируса. Имея ее, мы понимаем, какие белки этот геном кодирует, что вот этот белок, например, — поверхностный, и на него должны образовываться антитела, и т.д. Берем фрагмент гена/ген целиком/несколько генов вируса, синтезируем и вставляем в генетическую конструкцию. Она будет кодировать вакцинный антиген и/или саму вакцину. Дальше — испытываем на животных.
— Хорошо, мы создали вакцину в пробирке. Потом адаптировали вирус под животное, ввели ему вакцину, заразили, вакцина подействовала. Это заняло 7 месяцев. Что дальше? Уже можно вакцинировать людей?
— Пока нет. Следующая стадия — проверка безопасности на людях: находим здоровых добровольцев и вводим им вакцину. Если побочных реакций нет, испытываем вакцину на людях, которые могут заразиться этим вирусом. Стадия клинических исследований может длиться год, два, три… Но и это не все.
Если клинические исследования прошли успешно, нужно зарегистрировать вакцину и привить, скажем, 40 млн человек. Для этого нужно произвести 40 миллионов доз. Что может оказаться даже более сложной задачей, чем разработка самой вакцины. И только когда мы прошли путь от идеи до миллионов привитых, можно сказать: «Мы создали вакцину». В случае пандемии, когда все что можно упрощается и есть готовые производственные мощности, этот путь может занять полтора-два года. И это самый оптимистичный прогноз.
по теме

Общество
Пострадавшие от карантина: адвокат о перегибах во время пандемии
— Как насчет пессимистичного?
— Может оказаться, что вы создали и произвели вакцину, зарегистрировали ее, привили людей — и тут обнаружили, что вакцина малоэффективна или дает побочные эффекты, которые не обнаружились в клинических исследованиях. Такая история была с вакциной от лихорадки Денге. При вакцинации ею возник феномен antibody-dependent enhancement — антитело-зависимого усиления инфекции. Вот как он выглядит. Вы ввели вакцину, и в организме образовались антитела, которые должны вас защищать. Но при заражении таким же или родственным вирусом антитела парадоксальным образом усиливают инфекцию. Для коронавирусов такой эффект описан, и разработчики вакцины против SARS-CoV-2 держат в уме этот феномен.
— Лаборатории по всему миру работают над вакциной и лекарством от коронавируса. Не эффективнее собрать рабочую группу из самых умных и талантливых, чтобы они работали вместе?
— Здоровую конкуренцию никто не отменял, а если собрать разных специалистов в одну лабораторию, все перессорятся, отстаивая свою точку зрения. (Смеется.) А если серьезно, то у каждой лаборатории есть своя специализация и свои технологии. Раньше был подход: «Одна болезнь — одна вакцина», и для каждой инфекции была своя технология получения вакцины. Но инфекций много, и разрабатывать под каждую что-то уникальное дорого, долго и просто невыгодно. Поэтому появляются платформенные технологии разработки и производства вакцин: есть некая универсальная платформа, и мы меняет в ней один вариабельный компонент под конкретную вакцину. При этом производственная цепочка остается неизменной. У кого именно получится создать вакцину? Получится создать ее на такой платформе или, наоборот, с использованием более традиционных подходов? Я не знаю. Никто не знает.
Источник
Огромный микромир
Пандемия коронавируса заставила миллионы людей задуматься о том, что наука на самом деле знает про мир вирусов. Может ли она защитить людей? Предсказать следующую атаку вирусов?
Об этом «РГ» беседует с молекулярным вирусологом, и.о. директора Института биомедицинских систем и биотехнологий Санкт-Петербургского политехнического университета Петра Великого, доктором биологических наук Андреем Васиным.
Андрей Владимирович, пандемия COVID-19 открыла нам глаза на то, что мир вирусов способен преподнести людям немало сюрпризов, хотя мы сталкиваемся с ними постоянно. Почему, на ваш взгляд, новый вирус оказался таким шоком для человечества?
Андрей Васин: Подавляющее большинство людей просто недооценивало опасность, которую представляют вирусы. Почти все слышали такие слова, как «Эбола», «птичий грипп», «вирус Зика», «атипичная пневмония». Но все это было в заголовках новостей и где-то далеко — в Африке, Юго-Восточной Азии, Южной Америке — и не касалось непосредственно нас. Не случайно, наверное, что страны Юго-Восточной Азии, которые сталкивались с некоторыми из перечисленных вирусов, оказались более подготовленными к реагированию на COVID-19, чем, например, страны Европы.
Охвативший весь мир «свиной грипп» (т.е. вирус гриппа A/h2N1), объявленный пандемией, воспринимался просто как осложненный грипп. Плюс к этому было много разговоров про то, что это все обман с целью отвлечения внимания людей от каких-то более важных проблем, «заговор фармкомпаний, чтобы продавать больше препаратов», и т.п. А сейчас оказалось, что угроза пандемии реальна и может затронуть всех. К такому повороту событий общество многих стран, мне кажется, не было готово.
Известно, что вирусы крайне изменчивы. Чем объясняется эта их способность?
Андрей Васин: В основе всей жизни на земле лежит процесс репликации, то есть копирования генома, который у всех клеточных форм жизни представлен молекулой ДНК. За этот процесс в клетках отвечают специальные ферменты, которые называются полимеразы. В процессе репликации ДНК (у человека размер генома, например, составляет 10 в девятой степени!) неизбежно возникают ошибки. Поэтому в процессе эволюции появились специальные ферменты, которые отвечают за репарацию, то есть за устранение этих ошибок. У вирусов геном может быть представлен молекулой как ДНК, так и РНК. При этом РНК-содержащие вирусы являются более изменчивыми и патогенными, чем ДНК-содержащие. В частности, к РНК-содержащим вирусам человека относятся ВИЧ, вирус Эбола, вирус Зика, вирусы гриппа и коронавирусы, в том числе COVID-19. Изменчивость РНК-содержащих вирусов связана с тем, что у них, как правило, нет систем репарации. В результате вирусная полимераза совершает ошибки довольно часто. Размер генома вируса гораздо меньше, поэтому у них на каждый цикл репликации приходится в среднем одна мутация. С учетом скорости размножения вируса и скорости его распространения в популяции число мутаций будет довольно велико, что и объясняет такую изменчивость.
Подавляющее большинство людей недооценивали опасность, которую представляют вирусы
А помимо постепенного накопления мутаций в геноме РНК-содержащих вирусов возможны и более резкие изменения, например, в процессе реассортации и рекомбинации. Реассортация — это перемешивание сегментов генома разных вирусов. Если эти сегменты были от вирусов разных хозяев (например, человека и птицы), такой новый вирус чаще всего бывает нежизнеспособным. Однако в редких случаях он все же получает возможность эффективно размножаться и передаваться от человека к человеку. Именно таким образом возникали все известные пандемии гриппа. Для некоторых вирусов с монолитным геномом возможна рекомбинация, то есть обмен фрагментами генома между разными штаммами.
В частности, такие механизмы встречаются у коронавирусов. Реассортация и рекомбинация приводят не к плавным, а к резким изменениям биологических свойств вируса. Такая изменчивость и является одним из ключевых факторов их способности ускользнуть от иммунитета человека.

Способность коронавирусов быстро меняться помогает им обойти иммунитет человека. Фото: Сергей Карпухин / ТАСС
В состоянии ли наука предсказать появление более опасных штаммов тех вирусов, которые давно циркулируют среди людей?
Андрей Васин: Наука в состоянии предположить, что может сделать уже известные вирусы более опасными, изучая их молекулярно-генетические механизмы. Мы можем предполагать, на какие вирусы стоит обратить особое внимание с точки зрения их пандемического потенциала. Но сказать, какое именно событие усилит патогенность вируса в реальности и тем более когда оно произойдет, к сожалению, пока невозможно.
Известно, что существует около 250 вирусов, вызывающих ОРВИ. Однако для них не создано ни тест-систем, ни вакцин. С чем это связано? И оправдано ли такое спокойствие человечества?
Андрей Васин: Сложно дать однозначный ответ. С одной стороны, обычные люди и даже многие медики считают, что вызванные вирусами респираторные заболевания в целом схожи друг с другом, и подход к их лечению примерно одинаковый. Единственное исключение составляет грипп, при этом многие люди гриппом называют все ОРВИ. Зачем тогда тратить время и деньги на их дифференциальную диагностику? Считается, что важно определить, вирус или бактерия вызвали заболевание, а если вирус, то грипп это или нет, а остальное неважно. Ведь специфических противовирусных препаратов для других респираторных вирусов нет — в отличие от множества антибиотиков против бактериальных инфекций. Но каждый вирус имеет свою собственную программу репликации в организме, поэтому и течение инфекции тоже будет отличаться, а значит, и схема лечения тоже должна иметь отличия. Как молекулярный вирусолог, я считаю, что ставить диагноз ОРВИ и не обращать внимания на то, какой вирус ее вызвал, неправильно. Возможно, медицинские вирусологи и инфекционисты не будут столь категоричны. Но я уверен, что по мере изучения респираторных вирусов нас ждет еще много сюрпризов, в том числе в механизмах их патогенеза и развития осложнений.
Инвестиции в вирусологию можно сравнить со страховым полисом на автомобиль
Но тест-системы на определение ОРВИ есть, они широко используются в системе надзора за гриппом и другими ОРВИ, осуществляемой, в частности, Национальным центром ВОЗ на базе НИИ гриппа им. Смородинцева Минздрава России. Что касается вакцин, то ОРВИ преимущественно вызваны РНК-содержащими, то есть сильно изменчивыми вирусами, и создать эффективную вакцину от них не так просто. Мы это видим на примере вакцины от гриппа, состав которой меняется ежегодно, и прививаемся мы ею не единожды в жизни, а практически каждый год. Попытки создать вакцины и против других ОРВИ предпринимались в 1960-е годы, но они оказались безуспешными. Ярким примером является респираторно-синцитиальная инфекция, вызывающая тяжелые заболевания нижних дыхательных путей, особенно у младенцев и детей младшего возраста. Была получена инактивированная вакцина, но на стадии клинических испытаний она не только не позволила защитить от инфекции, но и существенно утяжелила заболевание. После этого работы по вакцине против РС-инфекции были надолго закрыты. Только в наше время вновь вернулись к активной разработке этих вакцин, когда открыли молекулярные механизмы усиления инфекции, возникавшего при использовании вакцины в те годы, но уже с использованием новых технологий. Сейчас на стадии доклинических и клинических исследований находится несколько десятков вакцинных препаратов. Мы также проводим доклинические исследования нашего варианта вакцины против РС-инфекции в НИИ гриппа, работа финансируется Центром стратегического планирования и управления медико-биологическими рисками здоровью Минздрава России.
А были ли попытки создать вакцины от коронавирусов?
Андрей Васин: Среди сезонных респираторных вирусов встречается 4 типа коронавирусов: OC43, HKU1, NL63 и 229E. И если про коронавирусы SARS (атипичной пневмонии) и MERS (ближневосточного респираторного синдрома) люди еще слышали, то про эти четыре коронавируса ничего не знают. Против них не было разработано ни лекарств, ни вакцин. Если бы они были, мы чувствовали бы себя сейчас намного уверенней и смогли бы гораздо быстрее создать вакцину или лекарственный препарат от COVID-19.
На нашей памяти — эпидемия Эбола в Африке, вспышки других опасных вирусных лихорадок. Какие уроки были извлечены из них?
Андрей Васин: Вирус Эбола был хорошо известен специалистам и до эпидемии. Локальные вспышки заболевания фиксировались, но при чрезвычайно высокой летальности число заболевших было невелико. Эпидемия столь опасного вируса особенно в условиях бедных стран Африки — это событие чрезвычайное, требующее неотложных мер, что в конечном итоге и было сделано. На момент начала эпидемии различными лабораториями разрабатывался целый ряд препаратов против вируса Эбола, в том числе с использованием новых технологий. Был определенный задел и по вакцинам, который позволил оперативно инициировать их разработку. Эпидемия Эбола позволила апробировать целый ряд новых биотехнологических решений, которые можно применять в дальнейшем для борьбы и с другими вирусными инфекциями.
Как вы полагаете, какие изменения в нашей жизни, в организации санэпиднадзора и системы здравоохранения должны будут произойти после нынешней пандемии?
Андрей Васин: Основные изменения будут связаны скорее всего с экономическими последствиями пандемии. ВОЗ постоянно говорит о необходимости подготовки к пандемиям, разработаны соответствующие «дорожные карты». После пандемии COVID-19 эта работа будет усилена как на глобальном уровне, так и на уровне отдельных стран. А в обычной жизни, надеюсь, люди будут уделять гораздо больше внимания правилам личной гигиены, более ответственно относиться к респираторным заболеваниям и не приходить, например, на работу или в места скопления людей с ОРВИ, заражая окружающих. По крайней мере, хотя бы в первое время.
Многие годы нам рекомендовали в качестве профилактики вирусных инфекций то витамины, то модуляторы интерферонов. Теперь об этом что-то молчат. Установки изменились?
Андрей Васин: Возможно, появилась ответственность за то, что предлагаешь, так как спрос на эти предложения будет действительно серьезный. Надеюсь, что одним из положительных последствий ситуации будет и более серьезное отношение к тому, чем предлагается лечить ОРВИ. А также то, что число сторонников антипрививочного движения сократится. Ведь вакцины — это одно из величайших достижений человечества, позволившее спасти миллиарды человеческих жизней.
Как вы считаете, нужно ли все же выделить средства на изучение вроде бы не очень опасных респираторных вирусов, разработку тест-систем, доступную диагностику, вакцинопрофилактику и терапию?
Андрей Васин: Несомненно! В «мирное» время кажется, что есть более важные задачи, но вирусы — это реальная угроза человечеству. Мы живем в условиях постоянной биологической войны, только не рукотворной, а природной, которая длится миллиарды лет. Мы никогда не сможем полностью исключить вирусную угрозу, но должны быть максимально готовы ее предотвратить. Биологическая наука развивается семимильными шагами. Например, всего за несколько дней после идентификации вируса COVID-19 его геном был секвенирован и депонирован в общедоступные базы данных, что позволило оперативно начать разработку тест-систем и вакцин. В 2009 году, во время пандемии гриппа, вызванного вирусом А/h2N1, этот процесс занял гораздо больше времени. Нам нужно более подробно изучать вирусы человека и животных. Не надо забывать, что основной путь появления новых инфекций — зоонозный, поэтому крайне важно знать, что происходит с вирусами в естественных животных резервуарах. Нужно развивать новые технологии создания вакцин и препаратов. В этом смысле многообещающе выглядят РНК-вакцины, неслучайно им сейчас уделяют столько внимания. Именно это направление мы выбрали в СПбГПУ как основное.
Не знаю, насколько уместно будет такое сравнение, но инвестиции в вирусологию — это как страховой полис на автомобиль. Пока с автомобилем все в порядке, кажется: зачем я заплатил за полис, лучше бы потратил на что-то более насущное. Но если с автомобилем что-то случилось, начинаешь понимать, что без страхового полиса ты остался бы ни с чем. Думаю, что даже небольшой части суммы экономических потерь от нынешней пандемии хватило бы на поддержание и оснащение вирусологических лабораторий по всему миру на многие годы.

Инфографика «РГ» / Александр Чистов / Татьяна Батенёва
Источник