Гранулематозное воспаление может возникнуть при кори
Осложнения кори
Корь — острое инфекционное вирусное заболевание с высоким уровнем заразности, характеризующееся общей интоксикацией, высокой температурой тела (до 40,5 °C), воспалением слизистых оболочек полости рта и верхних дыхательных путей, конъюнктивитом и характерной пятнисто-папулезной сыпью кожных покровов.
Корь передается воздушно-капельным путем, вирус выделяется со слюной при разговоре, кашле, с капельками слюны распространяется потоками воздуха не только в помещении, где находится больной, но может проникать по вентиляционной системе даже на другие этажи жилого дома. Больной корью заразен для окружающих с последних дней инкубационного периода (последние 2 дня) до 4-го дня высыпаний. С 5-го дня высыпаний больной считается незаразным. Корь является антропонозным заболеванием, животные и птицы не болеют корью и не могут быть ее переносчиками.
Инкубационный период кори составляет в среднем 8-14 дней, при атипичной кори инкубационный период может удлиняться до 21 дня. Доля кори характерно острое начало – резкий подъем температуры до 38-40 °C, головная боль, резь в глазах, слезотечение, покраснение и отек глаз, сухой кашель, насморк. Поэтому, часто первые признаки заболевания можно ошибочно принять за проявления гриппа, либо других респираторных инфекций. Однако, при осмотре зева, можно увидеть коревую энантему — красные пятна на твердом и мягком нёбе. На 2-й день болезни на слизистой щек в области больших коренных зубов появляются мелкие белёсые пятнышки, окруженные узкой красной каймой — пятна Бельского-Филатова-Коплика — характерные только для кори. Коревая сыпь (экзантема) появляется на 4-5-й день болезни, сначала на лице, шее, за ушами, на следующий день на туловище и на 3-й день высыпания покрывают разгибательные поверхности рук и ног, включая пальцы. Сыпь состоит из мелких папул, окруженных пятном и склонных к слиянию (в этом её характерное отличие от краснухи, сыпь при которой не сливается).
Начиная с 4 дня температура тела нормализуется, сыпь приобретает темный оттенок и начинает шелушиться. Через 1,5-2 недели сыпь полностью исчезает.
При кори, особенно при ее сложном, атипичном течении, возможно развития различных осложнений, связанных с поражением дыхательной, пищеварительной и центральной нервной систем.
Именно с осложнениями кори связано большинство летальных исходов заболевания. Чаще всего осложнения развиваются у невакцинированных детей до 5-ти лет, а также у взрослых, старше 20-ти лет. Опасна корь для беременных женщин. У них часто наблюдаются осложнения, кроме того корь может провоцировать преждевременные роды или самопроизвольный аборт. При этом плод также заражается и болеет, часто дети рождаются с характерной коревой сыпью
1. Первичные коревые осложнения, возникают в разгар болезни. Одновременно со смягчением коревой интоксикации и с окончанием высыпаний, изменения, обусловленные указанными осложнениями, тоже ослабевают. Как правило, первичные коревые осложнения, протекают в виде ларингитов, трахеобронхитов и других заболеваний дыхательной системы. Редким и грозным осложнением кори является энцефалит. Чаще энцефалит развивается уже на спаде интоксикации, в конце периода высыпаний, в период перехода в стадию пигментации. Наблюдается это заболевание преимущественно у детей более старшего возраста, оно чрезвычайно опасно, протекает тяжело, может привести к смерти больного или оставить тяжелые изменения (параличи, нарушения психики, эпилепсия).
2. Осложнения, вызываемые вторичной инфекцией, затрагивают в основном органы дыхательной и пищеварительной систем. Часто, бактериальные осложнения кори развиваются после контакта с детьми и взрослыми, имеющими воспалительные процессы. Больные корью могут легко инфицироваться острыми респираторными вирусными инфекциями, которые увеличивают вероятность возникновения бактериальных осложнений. Частота осложнений обратно пропорциональна возрасту больных, максимум их приходится на детей первых 3 лет жизни. Имеет значение и состояние больного. Осложнения чаще возникают и протекают более тяжело у ослабленных, непривитых детей.
Вторичные осложнения могут возникать в любом периоде кори. Появляясь в ранние сроки, они «утяжеляют» течение кори и сами протекают более тяжело. Для правильного лечения очень важно своевременно выявить осложнения, что в ранние сроки заболевания часто затруднительно, из-за маскировки выраженными проявлениями основного заболевания. В более поздние сроки диагностика осложнений облегчается, так как симптомы кори сглаживаются, температура снижается.
Осложнения со стороны органов дыхания включают весь диапазон возможных воспалительных процессов в этой системе (риниты, ларингиты, трахеиты, бронхиты, бронхиолиты, плевриты, пневмонии).
До 40-х годов прошлого века, пневмонии при кори чаще всего были пневмококковой этиологии, на втором месте стояли стрептококковые и более редкими были стафилококковые пневмонии. После введения в практику антибиотиков пневмококковые и стрептококковые пневмонии постепенно уступили место стафилококковым, которые до настоящего времени сохраняют господствующее положение.
Вторичные пневмонии у больных корью часто протекают тяжело, становятся обширными, могут сопровождаться абсцедированием, развитием плевритов.
Среди вторичных осложнений довольно часто встречаются ларингиты, вызываемые преимущественно стафилококками.
Осложнения со стороны органов пищеварения протекают более благоприятно. В ряде случаев наблюдаются стоматиты, в настоящее время преимущественно катаральные, афтозные. В прошлом отмечались гангренозные формы (нома).
Поражение органов слуха проявляется, главным образом, в виде отитов, как правило, катаральных, обусловленных распространением воспалительного процесса из зева. По этой же причине могут возникать шейные лимфадениты. Редко могут наблюдаться гнойные отиты.
Поражение глаз, как правило, в виде блефаритов, кератитов.
Поражение кожи проявляются в виде гнойничковых заболеваний.
Одним из самых грозных осложнений при кори является гнойный менингит бактериальной природы, развившийся вследствие генерализации инфекции.
Профилактика
Единственным надежным способом профилактики кори является вакцинация. В нашей стране вакцинация проводится в плановом порядке, в соответствии с Национальным календарем профилактических прививок, который регламентирует сроки введения препаратов и предусматривает плановую вакцинацию до 35 лет.
После двукратного введения вакцины риск заболеть корью не превышает 5%. Всем детям, которые находились в контакте с больным, проводится экстренная профилактика, которая заключается во введении человеческого иммуноглобулина на протяжении первых 5-и дней от момента контакта. Препарат вводится с целью экстренной профилактики лицам с противопоказаниями к вакцинации и детям в возрасте до 1-го года.
В некоторых случаях, после введения вакцины или человеческого иммуноглобулина, возникает митигированная корь — такая форма заболевания, которая протекает более легко, характеризуется отсутствием ряда симптомов, слабой интоксикацией.
Специфических лекарственных средств лечения кори нет, поэтому только прививка сможет защитить Вас и Вашего ребенка от кори.
Памятка ФБУЗ «Центр гигиенического образования населения» РОСПОТРЕБНАДЗОРА
При полном или частичном копировании информационного материала ссылка на сайт Управления Роспотребнадзора по Волгоградской области обязательна: https://34.rospotrebnadzor.ru/
Источник
Гранулематозные болезни кожи. Причины. Симптомы. Диагностика. Лечение
В основе гранулематозного воспаления лежат иммунные нарушения — главным образом по типу гиперчувствительности замедленного типа, аллергические и цитотоксические реакции. По мнению А.А. Ярилина (1999), развитие гранулемы, как правило, служит показателем неэффективности иммунной защиты. Появление гранулем в ходе воспалительного процесса нередко связано с несостоятельностью мононуклеарных фагоцитов, которые не могут переварить возбудителя, а также с персистированием последнего в тканях.
В связи с особенностями реакции организма на тот или иной агент гранулематозное воспаление называют также специфическим. Оно характеризуется определенным возбудителем, сменой и полиморфизмом тканевых реакций в соответствии с состоянием иммунной системы организма, хроническим волнообразным течением, преобладанием продуктивной реакции гранулематозного характера и развитием коагуляционного некроза в очагах воспаления. К инфекционным заболеваниям, характеризующимся специфичностью реакции, относят туберкулез, сифилис, лепру, склерому. Воспалительный процесс при этих заболеваниях имеет, как обычно, все компоненты: альтерацию, экссудацию и пролиферацию, но, кроме того, ряд определенных морфологических признаков в виде гранулемы — довольно четко отграниченного скопления гистиоцитов или эпителиоидных клеток в дерме на фоне хронической воспалительной инфильтрации, нередко с примесью гигантских многоядерных клеток.
Эпителиоидные клетки представляют собой разновидность макрофагов, содержат гранулярную эндоплазматическую сеть, синтезируют РНК, но к фагоцитозу мало способны, однако обнаруживают способность к пиноцитозу малых частиц. Эти клетки имеют неровную поверхность из-за большого количества микроворсинок, плотно соприкасающихся с микроворсинками соседних клеток, в результате чего в гранулеме они тесно прилежат друг к другу. Считается, что гигантские клетки образуются из нескольких эпителиоидных клеток благодаря слиянию их цитоплазмы.
Классификация гранулематозного воспаления чрезвычайно трудна. Как правило, при этом основываются на патогенетических, иммунологических и морфологических критериях. W.L. Epstein (1983) делит все гранулемы кожи, в зависимости от этиопатогенетического фактора, на следующие типы: гранулему инородного тела, инфекционные, иммунные, связанные с первичным повреждением ткани и не связанные с тканевыми повреждениями. О. Reyes-Flores (1986) классифицирует гранулематозное воспаление в зависимости от иммунного статуса организма. Он различает иммунекомпетентное гранулематозное воспаление, гранулематозное воспаление с неустойчивым иммунитетом и иммунодефицитное.
А.И. Струков и О.Я. Кауфман (1989) разделили все гранулемы на 3 группы: по этиологии (инфекционные, неинфекционные, медикаментозные, пылевые, гранулемы вокруг инородных тел, неустановленной этиологии); гистологии (гранулемы из зрелых макрофагов, с/без эпителиоидных, или гигантских, многоядерных клеток, с некрозом, фиброзными изменениями и др.) и патогенезу (иммунные гиперчувствительные гранулемы, неиммунные гранулемы и др.).
B.C. Hirsh и W.C. Johnson (1984) предложили морфологическую классификацию, учитывающую выраженность тканевой реакции и преобладание в этом процессе того или иного типа клеток, наличие нагноения, некротических изменений и инородных тел или инфекционных возбудителей. Авторы различают пять типов гранулем: туберкулоидную (эпителиоидно-клеточную), саркоидную (гистиоцитарную), типа инородных тел, некробиотическую (палисадообразную) и смешанную.
Туберкулоидные (эпителиоидно-клеточные гранулемы) встречаются главным образом при хронических инфекциях (туберкулез, поздний вторичный сифилис, актиномикоз, лейшманиоз, риносклерома и др.). Они образованы эпителиоидными и гигантскими многоядерными клетками, среди последних преобладают клетки Пирогова-Лангханса, но встречаются и клетки инородных тел. Для этого типа гранулем характерно наличие широкой зоны инфильтрации лимфоцитарными элементами вокруг скоплений эпителиоидных клеток.
Саркоидная (гистиоцитарная) гранулема представляет собой тканевую реакцию, характеризующуюся преобладанием в инфильтрате гистиоцитов и многоядерных гигантских клеток. В типичных случаях отдельные гранулемы не склонны к слиянию между собой и окружены венчиком из очень небольшого количества лимфоцитов и фибробластов, которые в самих гранулемах не определяются. Гранулемы этого типа развиваются при саркоидозе, внедрении циркония, при татуировке.
Некробиотические (палисадообразные) гранулемы встречаются при кольцевидной гранулеме, липоидном некробиозе, ревматических узелках, болезни кошачьих царапин и венерическом лимфогранулеме. Некробиотические гранулемы могут быть различного генеза, некоторые из них сопровождаются глубокими изменениями сосудов, чаще первичного характера (гранулематоз Вегенера). Гранулема инородных тел отражает реакцию кожи на инородное тело (экзогенное или эндогенное), характеризуется скоплениями вокруг него макрофагов и гигантских клеток инородных тел. В смешанных гранулемах, как следует из названия, сочетаются признаки разных типов гранулем.
Гистогенез гранулематозного воспаления подробно описан D.O. Adams. Экспериментально этот автор показал, что развитие гранулемы зависит от характера вызывающего агента и состояния организма. В начальных фазах процесса появляется массивный инфильтрат из юных мононуклеарных, фагоцитов, гистологически напоминающий картину хронического несиецифического воспаления. Через несколько дней этот инфильтрат превращается в зрелую гранулему, причем агрегаты зрелых макрофагов располагаются компактно, они превращаются в эпителиоидные, а затем в гигантские клетки. Этот процесс сопровождается ультраструктурными и гистохимическими изменениями мононуклеарных фагоцитов. Так, юные мононуклеарные фагоциты представляют собой относительно мелкие клетки, имеют плотные гетерохроматиновые ядра и скудную цитоплазму, в которой содержатся немногочисленные органеллы: митохондрии, комплекс Гольджи, зернистая и гладкая эндоплазматическая сеть и лизосомы. Эпителиоидные клетки крупнее, имеют эксцентрически расположенное эухроматиновое ядро и обильную цитоплазму, содержащую, как правило, большое количество органелл.
При гистохимическом исследовании в мононуклеарных фагоцитах в начале их развития выявляются пероксидазоположительные гранулы, напоминающие таковые в моноцитах, в этпелиоидных клетках отмечаются прогрессирующее растворение первичных пероксидазоположительных гранул и увеличение количества пероксисом. При прогрессировании процесса в них появляются лизосомальные ферменты, такие как бета-галактозидаза. Изменения ядер клеток гранулемы от маленьких гетерохроматиновых до крупных эухроматиновых обычно сопровождаются синтезом РНК и ДНК.
Кроме описанных выше элементов гранулемы, в ней встречаются в различном количестве нейтрофильные и эозинофильные гранулоциты, плазмоциты, Т- и В-лимфоциты. В гранулемах очень часто наблюдается некроз, особенно в случаях высокой токсичности aгентов, вызвавших гранулематозное воспаление, таких как стрептококки, кремний, микобактерии туберкулеза, гистоплазмы. Патогенез некроза в гранулемах точно неизвестен, однако имеются указания на влияние таких факторов, как кислые гидролазы, нейтральные протеазы и различные медиаторы. Кроме того, придают значение лимфокинам, влиянию эластазы и коллагеназы, а также спазмам сосудов. Некроз может быть фибриноидным, казеозным, иногда сопровождается размягчением или гнойным расплавлением (абсцедировоние). Инородный материал или возбудитель в гранулемах. подвергаются деградации, однако они могут вызвать иммунный ответ. Если вредные вещества полностью инактивируются, то гранулема регрессирует с образованием поверхностного рубца.
Если же этого не происходит, то указанные вещества могут находиться внутри макрофагов и отделяются от окружающих тканей фиброзной капсулой или секвестрируются.
Формирование гранулематозного воспаления контролируется Т-лимфоцитами, которые распознают антиген, превращаются в бластные клетки, способные информировать другие клетки и лимфоидные органы, участвуют в процессе пролиферации вследствие продукции биологически активных веществ (интерлейкин-2, лимфокины), называемых макрофагально-активными хемотаксическими факторами.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Источник
Современные представления о хронической гранулематозной болезни (ХГБ)
Хроническая гранулематозная болезнь (ХГБ) — достаточно неплохо изученное на сегодняшний день наследственное заболевание, связанное с недостаточностью фагоцитарной системы, следствием которой является иммунодефицит. Впервые ХГБ была описана в 1959 году у детей, для которых болезнь оказалась смертельной [1]. Болезнь не поддавалась лечению; на аутопсии выявляли генерализованное гранулематозное воспаление, отличающееся по своей специфике от известных на тот момент инфекционных и неинфекционных заболеваний.
Сегодня нам известно намного больше. Заболевание в большинстве случаев более не является смертельным, выявляется в основном у детей (врожденный иммунодефицит проявляется достаточно быстро), неплохо купируется. Однако до сих пор ХГБ относится к заболеваниям неизлечимым.
Этиология и патогенез
Сущность хронической гранулематозной болезни — в недостаточности фермента НАДФ-оксидазы, который представляет собой комплекс каталитических протеинов. Этот фермент, находясь в фагоцитирующих клетках, обеспечивает перенос электрона с НАДФ на молекулярный кислород: происходит т. н. «респираторный взрыв» (см. Рис. 1). Строго говоря, данный фермент есть не только у фагоцитов: единственным специфичным для них белком является трансмембранный gp91, остальные же компоненты встречаются в самых разных клетках [2].
Именно этот респираторный взрыв и позволяет завершить фагоцитоз и лизировать микроб, в противном же случае будет наблюдаться феномен эндоцитобиоза — он же «незавершенный фагоцитоз» — когда микроб просто живет внутри клетки. Фагоцит вполне себе поглотит бактерию, а убить не сможет. Таков механизм развития многих тяжелых инфекций (например, туберкулеза) [3]; эта же патология лежит в основе и других первичных иммунодефицитов [4].
Обратимся к рисунку 1. Белки gp91 и p22 объединяют в цитохром b558 — мембраносвязанную часть фермента НАДФ-оксидазы, остальные протеины называют цитозольными. При активации фагоцита различными медиаторами цитозольные p47 и p67 фосфорилируются и связываются вместе. Комплекс приобретает сродство к белкам p47 и rac2 — таким образом, присоединяясь к ним, данные протеины вызывают конформационные изменения в мембранном цитохроме b558, — и комплекс приобретает оксидазную активность [2, 5]. НАДФ-оксидаза переносит электрон от своего кофермента НАДФ на кислород с формированием активных форм кислорода (АФК) — O2- и H2O2. Вот здесь и начинается самое интересное.
Классически считается, что фагоцит убивает микробы, образуя фаголизосому с бактерией или грибом, воздействуя на них большими дозами высокотоксичных АФК; однако в последнее время приобретает актуальность иная точка зрения. В 2002 году в Nature была опубликована статья, авторы которой пересмотрели всю парадигму деактивации поглощенных микробов.
Ученые обнаружили, что если в фагоцитах мышей определяется нормальный уровень активных форм кислорода, но имеется недостаточность лизосомальных ферментов — животные будут беззащитны против стафилококковых и кандидозных инфекций. То есть, несмотря на наличие нормального респираторного взрыва, иммунодефицит все равно присутствует. Стало быть, эффекторами в инактивации микроба являются не сами АФК [6].
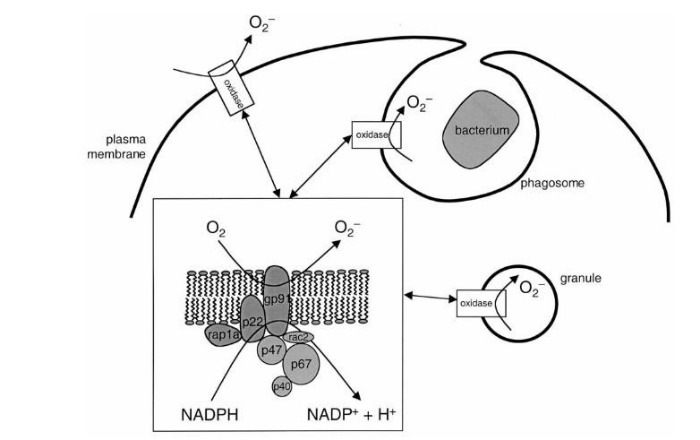 Рисунок 1. Механизм формирования NADPH-оксидазы [5].
Рисунок 1. Механизм формирования NADPH-оксидазы [5].
Согласно новой модели, АФК являются медиаторами в уничтожении микроба, а непосредственные «убийцы» — ферменты лизосом, обладающие протеолитической активностью. Как известно, при захвате фагоцитом микроба формируется вакуоль — (фагосома), с которой впоследствии сливается лизосома макрофага [7]. На мембране этой вакуоли и функционирует НАДФ-оксидаза, постоянно увеличивая концентрацию АФК. Однако как уже было сказано, данный процесс — не конечный эффекторный механизм.
Предположительно, супероксид-анион (O2-) вызывает приток ионов калия. K+, в свою очередь, приводит pH к оптимальным для функционирования протеолитических ферментов показателей. В роли калиевых каналов, возможно, может выступать как обычный протонный канал, так и сам комплекс НАДФ-оксидазы (который в данном случае будет представлен в качестве белка-переносчика) [6, 8].
Наследование и генетика
Хроническая гранулематозная болезнь имеет наследственную природу. Приблизительно данной патологией страдает 1 на 250 000 [9], что делает заболевание достаточно редким и потому трудным в диагностическом отношении. Заболевание вызывает мутация любого из четырех генов, кодирующих субъединицы ключевого фермента фагоцитоза НАДФ-оксидазы. Более двух третей случаев связаны с X-сцепленным наследованием (дефект гена CYBB, кодирующего белок p-91); остальные случаи связаны с аутосомно-рецессивным наследованием генов CYBA, NCF-1 и NCF-2, кодирующих белки p22, p47 и p67 соответственно. Исходя из этого болезнь обозначают как ХГБ X91, A22, A47 и A67 (в зависимости от типа наследования и локуса гена) [10].
Примечательно, что в литературе нет (или крайне мало) доказанных случаев наследственного дефекта других субъединиц. Однако в последнее время обнаруживаются все новые мутации генов, следствием которых становится ХГБ: например, в 2009 году выделили еще один подвид ХГБ, связанный с аутосомно-рецессивной мутацией гена p-40 [11], имеются также сведения о единственном пациенте с недостаточностью белка Rac2 — [10]. Вполне вероятно, что могут существовать и другие генетические патологии, вызывающие данное заболевание.
Диагностика
Диагностика ХГБ основана на выявлении клинических признаков, кроме того, важно выявить наличие или отсутствие респираторного взрыва. Последнее можно осуществить несколькими гистологическими и иммунологическими методами, например, окрашивание нитросиним тетразолием (НТЗ) позволяет определить, вырабатывают ли клетки АФК — НТЗ будет утилизироваться активными формами кислорода, в результате чего из бледно-желтого тетразолия образуется голубой формазан [12].
Среди наиболее ярких клинических симптомов можно выделить: пиодермию, пневмонию, воспалительные процессы желудочно-кишечного тракта, лимфаденит, абсцесс печени и остеомиелит [13] на фоне рецидивирующих бактериальных и грибных инфекций.
В крови выявляется гипергаммаглобулинемия и анемия. В местах дренажей — хроническое воспаление с образованием гранулем. Также гранулемы могут формироваться в различных тканях и органах: например, в желудке гранулематозное воспаление способно привести к обструкции желудочного канала, в урогенитальном тракте — к циститу. Также следует упомянуть, что почти 20 % больных ХГБ страдает от гранулематозного колита, который легко перепутать с болезнью Крона [14].
Основную же опасность для жизни пациента представляют различные инфекции. Примечательно, что поражают организм достаточно небольшой спектр бактерий и грибов: Staphylococcus, Burkholderia, Serratia, Nocardia, и некоторые грибы рода Aspergillus, реже — Salmonella и Mycobacterium tuberculosis [15, 16]. Несколько реже встречается инфицирование Chromobacterium violaceum (бацилла семейства Neisseriaceae, вызывающая тяжелые инфекционные осложнения в виде кожных фурункулов, абсцессов внутренних органов и септического поражения) [17]. Все они требуют специфического лечения. Кроме того, поражение органов также может быть стереотипным (см. Рис.2).
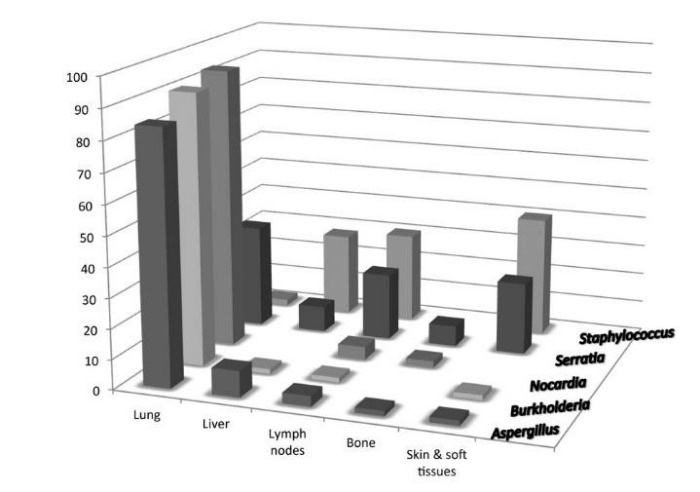 Рисунок 2. Сравнительная характеристика частоты органных поражений при некоторых инфекциях у пациентов с ХГБ [15].
Рисунок 2. Сравнительная характеристика частоты органных поражений при некоторых инфекциях у пациентов с ХГБ [15].
Также следует упомянуть о недавно открытой бактерии, выявленной у пациентов с ХГБ, которую исследователи предложили назвать Granulobacter bethesdensis. Это грамотрицательная палочка, которая на данный момент не может быть отнесена ни к одной из существующих таксономических групп; бактерия поражает лимфоузлы, кроме того, резистентна к антибиотикам in vitro и, скорее всего, — in vivo [18, 19]. Предполагается, что это — лишь первая из подобных бактерий, возникшая в эру антибиотиков. На данный момент Granulobacter bethesdensis не слишком распространена, однако имеет к этому весьма опасную тенденцию.
Лечение
В настоящее время активно разрабатываются методики, которые смогут не просто позволить больным с ХГБ жить полноценно, но и в перспективе совершенно избавить их от бремени заболевания. Поскольку болезнь наследственная, крайне трудно придумать что-то существенное, однако такие попытки предпринимаются, и некоторые из них обнадеживают.
Одна из них — лечение хронической гранулематозной болезни с помощью генной инженерии [20]. В 2006 году в Nature Medicine была опубликована статья, авторы которой сообщили об успешной коррекции генома двух пациентов с X-сцепленной формой ХГБ. После лечения у пациентов определяли активность нейтрофилов с помощью позитронно-эмиссионной томографии, а также других инструментальных методов. Исследование показало, что в обоих случаях фагоциты после проведенного лечения смогли оказать сопротивление инфекции. На данный момент это — одна из самых многообещающих методик.
Еще одним способом терапии является пересадка гемопоэтических клеток [21]. Двадцати семи пациентам после миелоаблативного режима кондиционирования (подготовка пациента к трансплантации с помощью лучевой или цитостатической терапии — прим. автора) пересадили гемопоэтические стволовые клетки от наиболее подходящих доноров (по белкам HLA — главного комплекса гистосовместимости). Двадцать три пациента вполне успешно перенесли операцию, а дальнейшее наблюдение позволило говорить об излечении этих пациентов от хронической гранулематозной болезни. Однако еще 4 пациента умерли от последующих инфекций (15 %).
В остальном же современная медицина может предложить крайне немного. Это — патогенетическая и симптоматическая терапия с использованием антибиотиков, дренажей и прочего. Излишне говорить, что подобное лечение не способно избавлять пациентов от ХГБ.
Профилактика инфекций.
Крайне важно предотвращение развития инфекционного процесса. Пациенты с ХГБ испытывают невероятные трудности в повседневной жизни, например, некачественная чистка зубов спокойно может окончиться гингивитом, а царапина — тяжелой бактериемией. Потому больным необходимо тщательным образом следить за гигиеной, выполнять профессиональную чистку зубов, обрабатывать все царапины антисептиком. И, разумеется, такие пациенты должны быть привиты по всем правилам [14]. В противном же случае даже достаточно простая инфекция может окончиться летально.
Источники:
- R. A. BRIDGES, H. BERENDES, and R. A. GOOD, “A Fatal Granulomatous Disease of Childhood,” AMA. J. Dis. Child., vol. 97, no. 4, p. 387, 1959.
- S. M. Holland, “Chronic Granulomatous Disease,” Clin. Rev Allerg Immunol, no. June 2009, pp. 3–10, 2010.
- B. D. L. Clemens and M. a Horwitz, “Characterization of the Mycobacterium mberctdosis Phagosome and Evidence that Phagosomal Maturation Is Inhibited,” Culture, vol. 181, no. January, 1995.
- W. Al-Herz et al., “Primary immunodeficiency diseases: an update on the classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency,” Front. Immunol., vol. 2, no. November, pp. 1–26, 2011.
- C. Dahlgren and A. Karlsson, “Respiratory burst in human neutrophils Claes,” J. Immunol. Methods, vol. 232, pp. 3–14, 1999.
- E. P. Reeves et al., “Killing activity of neutrophils is mediated through activation of proteases by K+flux,” Nature, vol. 416, no. 6878, pp. 291–297, 2002.
- A. Aderem and D. M. Underhill, “Mechanisms of Phagocytosis in Macrophages,” Annu. Rev. Immunol., vol. 17, no. 1, pp. 593–623, 1999.
- A. Maturana et al., “Heme Histidine Ligands within gp91phox Modulate Proton Conduction by the Phagocyte НАДФ Oxidase,” J. Biol. Chem., vol. 276, no. 32, pp. 30277–30284, 2001.
- J. M. van den Berg et al., “Chronic granulomatous disease: The European experience,” PLoS One, vol. 4, no. 4, pp. 1–10, 2009.
- P. G. H. Ãy, A. R. Cross, and J. T. C. Ã, “Chronic granulomatous disease,” no. 15, pp. 578–584, 2003.
- J. D. Matute et al., “A new genetic subgroup of chronic granulomatous disease with autosomal recessive mutations in p40phox and selective defects in neutrophil НАДФ oxidase activity,” Blood, vol. 114, no. 15, pp. 3309–3316, 2009.
- M. D. . Brahm H. Segal, P. D. . Thomas L. Leto, M. D. . John I. Gallin, M. D. . Harry L. Malech, and M. D. Steven M. Holland, “Genetic, biochemical, and clinical features of chronic granulomatous disease.” 2000.
- J. A. Winkelstein et al., “Chronic Granulomatous Disease.” 2000.
- R. A. Seger, “Modern management of chronic granulomatous disease,” Br. J. Haematol., vol. 140, no. 3, pp. 255–266, 2008.
- B. E. Marciano et al., “Common severe infections in chronic granulomatous disease,” Clin. Infect. Dis., vol. 60, no. 8, pp. 1176–1183, 2015.
- N. Bennett, P. J. Maglione, B. L. Wright, and C. Zerbe, “Infectious Complications in Patients With Chronic Granulomatous Disease,” vol. 7, no. June, 2018.
- Z. Meher-Homji, R. P. Mangalore, P. D. R. Johnson, and K. Y. L. Chua, “Chromobacterium violaceum infection in chronic granulomatous disease: a case report and review of the literature,” JMM Case Reports, vol. 4, no. 1, 2017.
- D. E. Greenberg et al., “A novel bacterium associated with lymphadenitis in a patient with chronic granulomatous disease,” PLoS Pathog., vol. 2, no. 4, pp. 260–267, 2006.
- D. E. Greenberg et al., “Recurrent granulibacter bethesdensis infections and chronic granulomatous disease,” Emerg. Infect. Dis., vol. 16, no. 9, pp. 1341–1348, 2010.
- M. G. Ott et al., “Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1,” Nat. Med., vol. 12, no. 4, pp. 401–409, 2006.
- R. A. Seger et al., “Treatment of chronic granulomatous disease with myeloablative conditioning and an unmodified hemopoietic allograft: A survey of the European experience, 1985-2000,” Blood, vol. 100, no. 13, pp. 4344–4350, 2002.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник