Цикл кори физиологическое значение
Содержание статьи
Печень умеет синтезировать глюкозу
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях — при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза, идущими в печени.
По определению, глюконеогенез — это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла — глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл — это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом — превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
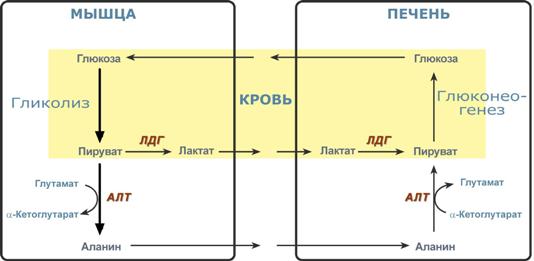
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача — доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
Схема глюконеогенеза:
В митохондриях: Лактат ↔ПВК → оксалоацетат (для этой р-ии:биотин,СО2,АТФ,пируваткарбоксилаза)→ малат .
Малат → (карбоксилаза, +ГТФ,- СО2) ФЭПВК(обход пируваткиназы) ↔ фру-1,6-дифосфат (обход фосфофруктокиназы) → (фосфотаза, -Фн) фру-6ф → (изомераза) глю-6ф (обход гексокиназы) → (глю-6-фосфотаза, -Фн) глюкоза -печень, почки
2 лактата + 6 АТФ → глюкоза.
Цикл Кори (глюкозо-лактатный цикл)
ПЕЧЕНЬ КРОВЬ МЫШЦЫ
Глю → глю → глю
↑ ↓
Гликоген
↓
Лактат ← 4/5 лактата ← 2 лактата
↓
ПВК
↓
АцКоА → ЦТК → СО2 + Н2О + АТФ
Значение цикла Кори:
— обеспечивает утилизацию лактата
— предотвращает накопление лактата и лактатный ацидоз
3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
О-цикл (цитозромоксидаза, IV цикл, цикл кислорода). Имеет 4 редокс-центра: 2 гема типа а(а и а3), 2 атома Сu — CuAи CuB
↓4Н
Цит С → CuA→ а → а3 → CuB→ ½ О2 → Н2О2 + Н2О
↑ ↓
2Н+О2 2Н, градиент
↑
Н2О2
Участники ферментативных компанентов определяют порядок (их потенциал-редокс)
Оксидоредуктаза катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования. Бактериальная форма фермента состоит из трех частей, эукариотическая из 13. Фермент катализирует восстановительно-окислительную реакцию — окисляются молекулы цитохрома с, восстанавливается кислород. В этой реакции потребляется практически весь кислород, нужный живым организмам в процессе дыхания. Каталитический центр фермента содержит гемы и медные комплексы. У эукариотов оксидазы находятся во внутренней митохондриальной мембране, у прокариотов во внутренней клеточной. Другие формы оксидазы встречаются в клеточной мембране аэробных бактерий; здесь, к примеру, в качестве электронного донора используются другие молекулы или же встречаются модифицированные гемы.
4.Физико-химические показатели мочи. Возрастные особенности.
органические вещества мочи: 1) белок в норме выделяется менее 0,002 гл (30-50 мгсут), если содержание больше — протеинурия 2) уробилин образуется при окислении билирубина в желчных путях и тонкой кишке 3)при нарушении синтеза гема в моче появляются промежуточные продукты синтеза порфиринового кольца и продукты распада гемоглобина 4) глюкоза при глюкозурии 5) кетоны 20-50 мгсут если больше кетонурия развивается 6) гемоглобин при гемоглобинурии 7) мочевина 333-583 ммольсут 8) мочевая кислота — конечный продукт пуриновых оснований1,2-1,7 9) ак при фенилкетонурии , при алкаптонурии, при нарушении синтеза мочевины 9) креатинин попадает в мочу путем клубочковой фильтрации 7,1-17,7
Глюкоза — это пороговое вещество и если ее больше в крови чем 11 ммоль/л она появляется с мочой. Глюкоза в норме обнаруживается только в суточном диурезе, в отдельных порциях она не обнаруживается; гликозурия — увеличение глюкозы. Почечная и внепочечная.
Протеинурия — высокое содержание белка в моче. По степени протеинурия может быть: а) слабо выраженная б) умеренно выраженная в) выраженная. Слабо выраженная — 156-506 мг/сут: при остром и хроническом гломерулонефрите; наследственном нефрите, тубулопатии, интерстициальном нефрите, обструктивной уропатии. Умеренно выраженная — 500-2000 мг/сут — при: остром и хроническом гломерулонефрите; наследственном нефрите. Выраженная — более 2000 мг/сут — при: нефротическом синдроме, амилоидозе.
Физиологические протеинурии связаны с временным появлением белка в моче и встречаются при: напряжении мышц, спортивных соревнованиях, приеме холодной ванны, душа, после эмоций. Функциональная протеинурия — ортостатическая протеинурия. Белок Бенс-Джонса — выделяется с мочой при миеломной болезни, макроглобулинемии Вальденстрема..
Ацетонурия. В моче в норме менее 0,01 в сутки, в отдельных порциях не обнаруживаются. Суточная экскреция кетоновых тел с мочой 20-50 мг. Кетонурия — резкое увеличение содержания кетонов в моче в результате их усиленного образования и нарушения процесса окисления. Наблюдается при: сахарном диабете, голодании, кахексии, гиперинсулинизме, тиреотоксикозах, в послеоперационном периоде, гликогенозах I, II, IV типов, акромегалии, инфекционных заболеваниях, интоксикации.
При обнаружении крови — гематурия, т.е. при обнаружении эритроцитов.
Микрогематурия — диагностируют только при микроскопическом исследовании осадка мочи.
Макрогематурия — определяется визуально, моча цвета мясных помоев.
В норме в моче определяется лишь единичные форменные элементы (лейкоциты 0-5, эритроциты 0-1).
Почечная гематурия — повышенная проницаемость почечного фильтра или поражение эпителия канальцев, или интерстиция почки.
Внепочечная наблюдается при травмах мочевыводящих путей, например камни, или при нарушении свертывающей системы крови — гемофилия.
Билет № 15
Соседние файлы в предмете Биохимия
- #
10.04.20151.23 Mб65biokhimia_ekz.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
7.6. Цикл кори
Цикл Кори (глюкозо-лактатный цикл) открыла чешская ученая, лауреат Нобелевской премии Тереза Кори. Он представляет собой биохимический транспорт лактата из мышц в печень и дальнейший синтез глюкозы из лактата, катализируемый ферментами глюконеогенеза:
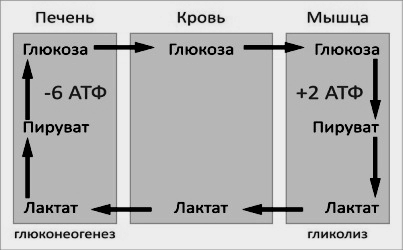
При интенсивной мышечной работе и в условиях отсутствия или недостаточного числа митохондрий (например, в эритроцитах) глюкоза подвергается анаэробному гликолизу с образованием лактата. При накоплении лактата в мышцах возникает лактат-ацидоз, раздражаются чувствительные нервные окончания, что вызывает боль в мышцах.
Лактат переносится кровью в печень и превращается в пируват, а затем в глюкозу (глюконеогенез), которая с током крови может возвращаться в работающую мышцу.
Направление лактатдегидрогеназной реакции в работающих мышцах и печени обусловлено отношением концентраций восстановленной и окисленной форм НАД+: отношение НАД+/НАДН в сокращающейся мышце больше, чем в печени.
7.7. Спиртовое брожение
Спиртовое брожение осуществляется дрожжеподобными организмами, а также некоторыми плесневыми грибками:
Механизм реакции близок к гликолизу. Расхождение начинается после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента НАДН восстанавливается в лактат. При спиртовом брожении пируват подвергается декарбоксилированию, в результате образуется ацетальдегид, а затем при восстановлении его — этанол:
При молочнокислом брожении ПВК не декарбоксилируется, а, как и при гликолизе в животных тканях, восстанавливается при участии ЛДГ за счет водорода НАДН.
7.8. Пентозофосфатный путь превращения глюкозы
Пентозофосфатный путь — альтернативный путь окисления глюкозы. Его функции:
— поставляет клеткам кофермент НАДФН, использующийся как донор водорода в реакциях восстановления;
— обеспечивает клетки пентозофосфатами для синтеза нуклеотидов и нуклеиновых кислот.
Пентозофосфатный путь не приводит к синтезу АТФ.
Ферменты пути локализованы в цитозоле.
В пентозофосфатном пути превращения глюкозы выделяют окислительный и неокислительный пути образования пентоз.
Окислительный путь включает две реакции дегидрирования. Коферментом дегидрогеназ является НАДФ+, восстанавливающийся в НАДФН. Пентозы образуются при окислительном декарбоксилировании.
Неокислительный путь включает реакции переноса 2- и 3-х углеродный фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Процесс обратим, и из пентоз могут образовываться гексозы.
Пентозофосфатный путь образования пентоз протекает в печени, жировой ткани, молочной железе, коре надпочечников, эритроцитах.
1). Дегидрирование глюкозо-6-фосфата при участии глюкозо-6-фос-фатдегидрогеназы и кофермента НАДФ+ с образованием 6-фосфоглюконо--лактона и НАДФН:
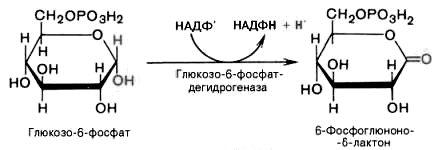
2). 6-фосфоглюконо--лактон нестабилен и гидролизуется с образованием 6-фосфоглюконата (фермент — 6-фосфоглюконолактоназа):
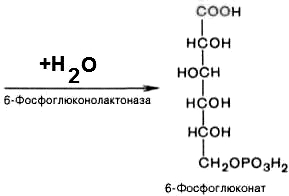
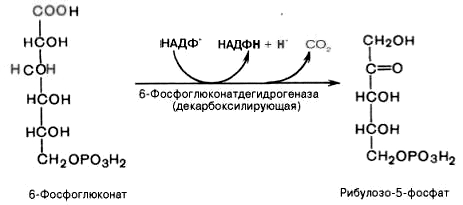
3). Дегидрирование и декарбоксилирование 6-фосфоглюконата с образованием рибулозо-5-фосфата (пентоза) и НАДФН при участии декарбоксилирующей 6-фосфоглюконатдегидрогеназы:
4). Под действием эпимеразы из рибулозо-5-фосфата образуется ксилулозо-5-фосфат (пентоза). Под влиянием изомеразы рибулозо-5-фосфат превращается в рибозо-5-фосфат (пентоза). Между формами пентозофосфатов устанавливается равновесие:
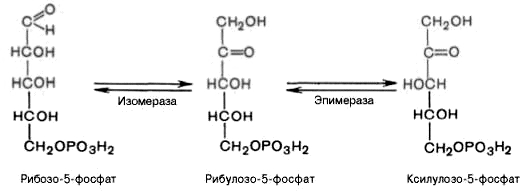
На этом этапе пентозофосфатный путь может быть завершен. При других условиях наступает неокислительная стадия пентозофосфатного цикла, протекающая в анаэробных условиях. Она заключается в переносе двух- и трехуглеродных фрагментов от одной молекулы к другой. При этом образуются вещества, характерные для гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), и вещества, специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Шесть молекул глюкозо-6-фосфата в пентозофосфатном цикле образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2. Из 6 молекул рибулозо-5-фосфата регенерируется 5 молекул глюкозо-6-фосфата:
Промежуточные продукты цикла (фруктозо-6-фосфат и глицеральдегид-3-фосфат) включаются в гликолиз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Cori cycle
The Cori cycle (also known as the lactic acid cycle), named after its discoverers, Carl Ferdinand Cori and Gerty Cori,[1] is a bolic pathway in which lactate produced by anaerobic glycolysis in muscles is transported to the liver and converted to glucose, which then returns to the muscles and is cyclically bolized back to lactate.[2]
Process[edit]
Muscular activity requires ATP, which is provided by the breakdown of glycogen in the skeletal muscles. The breakdown of glycogen, known as glycogenolysis, releases glucose in the form of glucose 1-phosphate (G1P). The G1P is converted to G6P by phosphoglucomutase. G6P is readily fed into glycolysis, (or can go into the pentose phosphate pathway if G6P concentration is high) a process that provides ATP to the muscle cells as an energy source. During muscular activity, the store of ATP needs to be constantly replenished. When the supply of oxygen is sufficient, this energy comes from feeding pyruvate, one product of glycolysis, into the citric acid cycle, which ultimately generates ATP through oxygen-dependent oxidative phosphorylation.
When oxygen supply is insufficient, typically during intense muscular activity, energy must be released through anaerobic bolism. Lactic acid fermentation converts pyruvate to lactate by lactate dehydrogenase. Most importantly, fermentation regenerates NAD+, maintaining its concentration so additional glycolysis reactions can occur. The fermentation step oxidizes the NADH produced by glycolysis back to NAD+, transferring two electrons from NADH to reduce pyruvate into lactate. (Refer to the main articles on glycolysis and fermentation for the details.)
Instead of accumulating inside the muscle cells, lactate produced by anaerobic fermentation is taken up by the liver. This initiates the other half of the Cori cycle. In the liver, gluconeogenesis occurs. From an intuitive perspective, gluconeogenesis reverses both glycolysis and fermentation by converting lactate first into pyruvate, and finally back to glucose. The glucose is then supplied to the muscles through the bloodstream; it is ready to be fed into further glycolysis reactions. If muscle activity has stopped, the glucose is used to replenish the supplies of glycogen through glycogenesis.[3]
Overall, the glycolysis steps of the cycle produce 2 ATP molecules at a cost of 6 ATP molecules consumed in the gluconeogenesis steps. Each iteration of the cycle must be maintained by a net consumption of 4 ATP molecules. As a result, the cycle cannot be sustained indefinitely. The intensive consumption of ATP molecules in the Cori cycle shifts the bolic burden from the muscles to the liver.
ificance[edit]
The cycle’s importance is based on preventing lactic acidosis during anaerobic conditions in the muscle. However, normally, before this happens, the lactic acid is moved out of the muscles and into the liver.[3]
Additionally, this cycle is important in ATP production, an energy source, during muscle exertion. The end of muscle exertion allows the Cori cycle to more effectively. This repays the oxygen debt so both the electron transport chain and citric acid cycle can produce energy at optimum effectiveness.[3]
The Cori cycle is a much more important source of substrate for gluconeogenesis than food.[4][5] The contribution of Cori cycle lactate to overall glucose production increases with fasting duration before plateauing.[6] Specifically, after 12, 20, and 40 hours of fasting by human volunteers, gluconeogenesis accounts for 41%, 71%, and 92% of glucose production, but the contribution of Cori cycle lactate to gluconeogenesis is 18%, 35%, and 36%, respectively.[6] The remaining glucose production comes from protein breakdown,[6] muscle glycogen,[6] and glycerol from lipolysis.[7]
The drug metformin can cause lactic acidosis in patients with kidney failure because metformin inhibits the hepatic gluconeogenesis of the Cori cycle, particularly the mitochondrial respiratory chain complex 1.[8] The buildup of lactate and its substrates for lactate production, pyruvate and alanine, lead to excess lactate.[9] Normally, the excess lactate would be cleared by the kidneys, but in patients with kidney failure, the kidneys cannot handle the excess lactic acid.
See also[edit]
- Alanine cycle
- Citric acid cycle
References[edit]
- ^ «Carl and Gerty Cori and Carbohydrate bolism». American Chemical Society. 2004. Retrieved 12 May 2020. CS1 maint: discouraged parameter ()
- ^ Nelson, David L., & Cox, Michael M.(2005) Lehninger Principles of Biochemistry Fourth Edition. New York: W.H. Freeman and Company, p. 543.
- ^ a b c «Cori Cycle d 2008-04-23 at the Wayback Machine». Retrieved May 3, 2008, from Elmhurst, pp. 1-3.
- ^ Gerich JE, Meyer C, Woerle HJ, Stumvoll M (2001). «Renal gluconeogenesis: Its importance in human glucose homeostasis». Diabetes Care. 24 (2): 382-391. doi:10.2337/diacare.24.2.382. PMID 11213896.
- ^ Nuttall FQ, Ngo A, Gannon MC (2008). «Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?». Diabetes/bolism Re and Reviews. 24 (6): 438-458. doi:10.1002/dmrr.863. PMID 18561209. S2CID 24330397.
- ^ a b c d Katz J, Tayek JA (1998). «Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans». American Journal of Physiology. 275 (3 Pt 1): E537-E542. doi:10.1152/ajpendo.1998.275.3.E537. PMID 9725823.
- ^ Cahill GF (2006). «Fuel bolism in starvation» (PDF). Annual Review of Nutrition. 26: 1-22. doi:10.1146/annurev.nutr.26.061505.111258. PMID 16848698.
- ^ Vecchio, S. et al. «Metformin accumulation: lactic acidosis and high plasmatic metformin levels in a retrospective case series of 66 patients on chronic therapy.», Clin Toxicol. 2014;52(2).
- ^ Sirtori CR, Pasik C. «Re-evaluation of a biguanide, metformin: mechanism of action and tolerability». Pharmacol Res 1994; 30.
Sources[edit]
- Smith, A.D., Datta, S.P., Smith, G. Howard, Campbell, P.N., Bentley, R., (Eds.) et al.(1997) Oxford Dictionary of Biochemistry and Molecular Biology. New York: Oxford University Press.
bolism: carbohydrate bolism: glycolysis/gluconeogenesis enzymes | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Glycolysis |
| ||||||||
| Gluconeogenesis only |
| ||||||||
| Regulatory |
| ||||||||
Источник
Цикл Кори — Cori cycle
Цикл Кори (также известный как цикл молочной кислоты ), названный в честь его первооткрывателей, Карла Фердинанда Кори и Герти Кори , представляет собой метаболический путь, в котором лактат вырабатывается анаэробным гликолизом в мышцах транспортируется в печень и превращается в глюкозу, которая затем возвращается в мышцы и циклически метаболизируется обратно в лактат.
Процесс
Мышечная активность требует АТФ , который обеспечивается расщеплением гликогена в скелете мышцы . Распад гликогена, известный как гликогенолиз , высвобождает глюкозу в форме глюкозо-1-фосфата (G1P). G1P превращается в G6P с помощью фосфоглюкомутазы . G6P легко вводится в гликолиз (или может переходить в пентозофосфатный путь , если концентрация G6P высока) процесс, который обеспечивает АТФ мышечными клетками в виде источник энергии. Во время мышечной активности необходимо постоянно пополнять запасы АТФ. Когда подача кислорода достаточна, эта энергия поступает от подачи пирувата , одного продукта гликолиза, в цикл лимонной кислоты .
. Когда подача кислорода недостаточна, обычно во время интенсивной мышечной активности энергия должна высвобождаться посредством анаэробного метаболизма . Молочнокислая ферментация превращает пируват в лактат с помощью лактатдегидрогеназы . Что наиболее важно, ферментация регенерирует NAD , поддерживая его концентрацию, поэтому могут происходить дополнительные реакции гликолиза. На стадии ферментации НАДН , полученный в результате гликолиза, окисляется обратно до НАД, передавая два электрона от НАДН для восстановления пирувата до лактата. (За подробностями обращайтесь к основным статьям по гликолизу и ферментации .)
Вместо того, чтобы накапливаться внутри мышечных клеток, лактат, произведенный анаэробной ферментацией, поглощается печень . Это инициирует вторую половину цикла Кори. В печени происходит глюконеогенез . С интуитивной точки зрения глюконеогенез обращает вспять как гликолиз, так и ферментацию, превращая лактат сначала в пируват, а затем обратно в глюкозу. Затем глюкоза поступает в мышцы через кровоток ; он готов к дальнейшим реакциям гликолиза. Если мышечная активность прекратилась, глюкоза используется для пополнения запасов гликогена посредством гликогенеза .
В целом на этапах гликолиза цикла вырабатываются 2 молекулы АТФ при затратах 6 молекул АТФ, потребляемых на этапах глюконеогенеза. Каждая итерация цикла должна поддерживаться чистым потреблением 4 молекул АТФ. В результате цикл не может продолжаться бесконечно. Интенсивное потребление молекул АТФ в цикле Кори сдвигает метаболическую нагрузку с мышц на печень.
Значение
Важность цикла основана на предотвращении лактоацидоза в мышцах в анаэробных условиях. Однако обычно, прежде чем это произойдет, молочная кислота перемещается из мышц в печень.
Цикл также важен для производства АТФ, источника энергии, во время мышечной активности. Цикл Кори функционирует более эффективно, когда мышечная активность прекращается. Это позволяет погашать кислородный долг, так что цикл лимонной кислоты и цепь переноса электронов могут производить энергию с максимальной эффективностью.
Цикл Кори является гораздо более важным источником субстрата для глюконеогенеза чем еда. Вклад лактата цикла Кори в общую продукцию глюкозы увеличивается с периодом голодания до выхода на плато. В частности, через 12, 20 и 40 часов голодания добровольцев-людей на глюконеогенез приходится 41%, 71% и 92% продукции глюкозы, но вклад лактата цикла Кори в глюконеогенез составляет 18%, 35% и 36%. % соответственно. Оставшееся производство глюкозы происходит за счет распада белка, мышечного гликогена и глицерина в результате липолиза .
Препарат метформин может вызывать лактоацидоз у пациентов с почечной недостаточностью потому что метформин ингибирует печеночный глюконеогенез цикла Кори, особенно комплекс 1 дыхательной цепи митохондрий. Накопление лактата и его субстратов для производства лактата, пирувата и аланина, приводит к избытку лактата. Обычно избыток лактата выводится почками, но у пациентов с почечной недостаточностью почки не могут справиться с избытком молочной кислоты.
См. Также
- цикл аланина
- цикл лимонной кислоты
Ссылки
- ^«Карл и Герти Кори и метаболизм углеводов» . Американское химическое общество. 2004. Проверено 12 мая 2020 г.
- ^Нельсон, Дэвид Л. и Кокс, Майкл М. (2005) Принципы биохимии Ленингера, четвертое издание. Нью-Йорк: W.H. Фримен и компания, стр. 543.
- ^ «Cori Cycle Архивировано 23 апреля 2008 г. на Wayback Machine «. Получено 3 мая 2008 г., из Элмхерста, стр. 1-3.
- ^Gerich JE, Meyer C, Woerle HJ, Stumvoll M (2001). «Почечный глюконеогенез: его значение в гомеостазе глюкозы человека» . Уход за диабетом . 24(2): 382-391 . doi : 10.2337 / diacare.24.2.382 . PMID11213896 .
- ^Nuttall FQ, Ngo A, Gannon MC (2008). «Регулирование выработки глюкозы в печени и роль глюконеогенеза у людей: постоянна ли скорость глюконеогенеза?» . Исследования и обзоры диабета / метаболизма. 24 (6): 438-458. doi : 10.1002 / dmrr.863 . PMID18561209 . S2CID24330397 .
- ^ Кац J, Tayek JA (1998). «Глюконеогенез и цикл Кори у людей, голодавших в течение 12, 20 и 40 часов» . Американский журнал физиологии . 275 (3 Pt 1): E537 — E542. doi : 10.1152 / ajpendo.1998.275.3.E537 . PMID9725823 .
- ^Кэхилл GF (2006). «Топливный обмен при голодании» (PDF). Ежегодный обзор питания . 26: 1-22. doi : 10.1146 / annurev.nutr.26.061505.111258 . PMID16848698 .
- ^Vecchio, S. et al. «Накопление метформина: лактоацидоз и высокие уровни метформина в плазме в серии ретроспективных клинических случаев у 66 пациентов, получающих хроническую терапию», Clin Toxicol. 2014; 52 (2).
- ^Сиртори С.Р., Пасик К. «Повторная оценка бигуанида, метформина: механизм действия и переносимость». Pharmacol Res 1994; 30.
Источники
- Smith, A.D., Datta, S.P., Smith, G. Howard, Campbell, P.N., Bentley, R., (Eds.) Et al. (1997) Oxford Dictionary of Biochemistry and Molecular Biology. Нью-Йорк: Oxford University Press.
Источник